-
下列热化学方程式书写正确的是( )

B.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
难度: 简单查看答案及解析
-
下列可逆反应达平衡后,升高温度可使混合气的平均分子量增大的是 ( )
A.N2(g)+3H2(g)
2NH3(g);△H<0
B.H2(g)+I2(g)
2HI(g);△H<0
C.2SO3(g)
2SO2(g)+O2(g);△H>0
D.4NH3(g)+5O2(g)
4NO(g)+6H2O(g);△H<0
难度: 简单查看答案及解析
-
在其它条件一定时,图中曲线表示反应:2NO(g) + O2(g)
2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正<V逆的点是( )

A.A或E B.B点 C.C点 D.D点
难度: 简单查看答案及解析
-
利用含碳化合物合成新燃料是发展低碳经济的重要方法,已知:CO(g) + 2H2(g)
CH3OH(g)过程能量情况如下图所示,曲线I和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )

A.加入催化剂,该反应的ΔH变小 B.该反应的ΔH=+91kJ·mol-1
C.反应物的总能量大于生成物的总能量 D.如果该反应生成液态CH3OH,则ΔH增大
难度: 简单查看答案及解析
-
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂 B.放电时正极上有氢气生成
C.放电时,正极附近碱性减弱 D.总反应为:2Li+2H2O===2LiOH+H2↑
难度: 简单查看答案及解析
-
已知:H2(g)+F2(g)===2HF(g);ΔH=-270kJ·mol-1,下列说法正确的是( )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270 kJ热量
B.1 mol 氢气与1 mol 氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量
D. 2 L氟化氢气体分解成1 L氢气和1 L氟气吸收270 kJ热量
难度: 简单查看答案及解析
-
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)== =CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.① B.④ C.②③④ D.①②③
难度: 简单查看答案及解析
-
下列叙述正确的是( )
①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率;
②镀层破损后,白铁(镀锌铁)比马口铁(镀锡铁)更易腐蚀;
③能自发进行的氧化还原反应,都可以设计原电池的装置
④铅蓄电池在放电过程中,负极质量减小,正极质量增加
⑤可用于电动汽车的铝-空气燃料电池,以NaOH溶液为电解液时,负极反应为:
Al+3OH--3e-=Al(OH)3↓
⑥实验室中用稀HNO3溶液与Cu反应制取NO气体反应很慢,加一块石墨使之与Cu接触后反应加快
A、②④⑤ B、①③⑥ C、①③④ D、②⑤⑥
难度: 简单查看答案及解析
-
碱性锌锰电池的总反应为:Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH),下列说法不正确的是( )
A.该电池Zn为负极,MnO2为正极,电解质是KOH
B.放电时外电路电流由Zn流向MnO2
C.电池工作时OH-向锌电极移动
D.该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH—
难度: 简单查看答案及解析
-
在一定温度下,体积恒定的密闭容器中反应 A(g)+ 3B(g)
2C(g)达到平衡的标志的是( )
(1)C的生成速率与C的分解速率相等; (2)单位时间内2amol C生成,同时生成3amol B;
(3)A、B、C的浓度不再变化; (4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化; (6)A、B、C的分子数目比为1:3:2。
A.(2)(4)(5) B.(2)(6) C. (1)(2)(3)(4)(5) D. (2)(5)(6)
难度: 简单查看答案及解析
-
下列说法正确,且能用原电池原理解释的是( )

A.合金一定比纯金属耐腐蚀
B.如图,在铁棒上产生气泡,碳棒上没有气泡
C.在锌与稀硫酸反应时,加入硫酸铜溶液可以加快反应速率
D.铝不需要特别处理就具有抗腐蚀能力
难度: 简单查看答案及解析
-
有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应式为:2H2+O2===2H2O,负极反应为H2+CO-2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
A.正极反应为2H2O+O2+4e-===4OH-
B.常温常压下每消耗22.4LH2向外电路提供的电子小于2mol
C.电子由正极经外电路流向负极
D.电池中CO的物质的量将逐渐减少
难度: 简单查看答案及解析
-
某心脏起搏器的动力来源于Li-SOCl2电池。该电池的总反应可表示为:
4Li+2SOCl2 = 4LiCl +S +SO2。下列关于该电池的说法正确的是( )
A.放电过程中Li+向负极移动
B.该电池的电解质溶液为NaCl水溶液
C.正极电极反应式为: 2SOCl2+4e- = 4Cl— +S +SO2
D.当0.4mol Li完全溶解时,流经电解质溶液的电子个数为2.408×1023
难度: 简单查看答案及解析
-
在一定条件下,可逆反应2A(g)+B(g)
nC(s)+D(g)达平衡。若维持温度不变,增大压强,测得混合气体的平均相对分子质量不变,则下列判断正确的是( )
A.其它条件不变,增大压强,平衡不发生移动
B.其它条件不变,增大压强,混合气体的总质量不变
C.该反应式中n值一定为2
D.原混合气中A与B的物质的量之比为2:1,且
难度: 简单查看答案及解析
-
已知:H2O(g)===H2O(l) ΔH=—Q1 kJ·mol-1
C2H5OH(g)===C2H5OH(l) ΔH=—Q2 kJ·mol-1
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=—Q3 kJ·mol-1
若使46 g液态酒精完全燃烧,最后恢复到室温,则放出的热量为( )
A.(Q1+Q2+Q3) kJ B.(Q2 —3Q1—Q3) kJ
C. (0.5Q1-1.5Q2+0.5Q3) kJ D.(3Q1-Q2+Q3) kJ
难度: 简单查看答案及解析
-
如图所示为可逆反应A+2B
2C+3D的化学反应速率随外界条件变化(先降温后加压)的关系图,由此可知( )

A.正向△H>0,B、C、D均为气体
B.正向△H<0,A、B、C为气体,D为液体或固体
C.正向△H>0,A、B为气体,D为液体或固体
D.正向△H<0,A为液体,C、D为气体
难度: 简单查看答案及解析
-
下图是温度和压强对X+Y
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
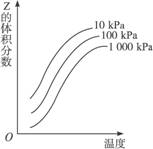
A、上述可逆反应的正反应为放热反应 B、X、Y、Z均为气态
C、X和Y中只有一种为气态,Z为气态 D、上述反应的逆反应为吸热反应
难度: 简单查看答案及解析
-
2011年中国已超北美成为全球液晶显示器第二大市场。生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键
N≡N
F—F
N—F
键能:kJ/mol
941.7
154.8
283.0
下列说法中正确的是 ( )
A.过程N2(g)→2N(g)放出能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)=2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
难度: 简单查看答案及解析
-
化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言。下列化学用语中,书写错误的是( )
A.硫离子的结构示意图:
B.NH4Cl的电子式:
C.CO2的电子式: ············ D.次氯酸的结构式:
难度: 简单查看答案及解析
-
某温度下的密闭容器中,发生如下可逆反应:2E(g)
F(g)+xG(g) △H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )
A. 升高温度时,正反应速率加快,逆反应速率减慢
B. 若x=1,容器体积保持不变,新平衡下E的体积分数为50%
C. 若x=2,容器体积保持不变,新平衡下F的平衡浓度为0.5a mol/L
D. 若x=2,容器压强保持不变,新平衡下E的浓度为a mol/L
难度: 简单查看答案及解析
-
某种电池的总反应为 Fe+NiO2 + 2H2O
Fe(OH)2+Ni(OH)2。下列有关该蓄电池的说法错误的是( )
A.放电时Fe是负极,NiO2是正极
B.放电时正极反应是:NiO2+H2O+2e-=。Ni(OH)2+2OH-
C.放电时负极反应为: Fe-2e-+2OH-=Fe(OH)2
D.该蓄电池的电极应该浸入某种碱性电解质溶液中
难度: 简单查看答案及解析
-
下列表示可逆反应:2A(g)+B(g)
D(g) △H<0的图示中正确的是( )
(atm压强的一种单位)

难度: 简单查看答案及解析
-
.以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,电池反应为:
有关下列说法错误的是( )
A.氨燃料电池在放电时,氨气被氧化
B.氨燃料电池在放电时,正极反应为:2NH3+6e-+6OH- N2+6H2O
C.以氨气代替氢气的主要原因是:氨气易液化易储存
D.燃料电池的能量转化率一般比普通的电池高
难度: 简单查看答案及解析
-
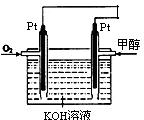
科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
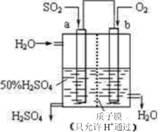
A.a为正极,b为负极 B.生产过程中H+ 向a电极区域运动
C.电子从b极向a极移动 D.负极反应式为:
难度: 简单查看答案及解析
-
已知某可逆反应:mA(g)+nB(g)
pC(g) 在密闭容器中进行,下图表示在不同时刻时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是 ( )
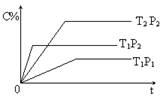
A、T2>T1 P1<P2 m+n<P △H<0 B、T1<T2 P1<P2 m+n<P △H<0
C、T1>T2 P2>P1 m+n>P △H<0 D、T1>T2 P1<P2 m+n>P △H>0
难度: 简单查看答案及解析
-
在25oC、1.01×105 Pa下,将2.2 g CO2通入75 mL 1 mol/L NaOH溶液中充分反应,测得反应放出x kJ 的热量.已知在该条件下,1 mol CO2通入1 L 2 mol/L NaOH溶液中充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)==NaHCO3(aq);ΔH=-(20y-x) kJ/mol
B.CO2(g)+NaOH(aq)==NaHCO3(aq);ΔH=-(4x-y) kJ/mol
C.CO2(g)+NaOH(aq)==NaHCO3(aq);ΔH=-(40x-y) kJ/mol
D.2CO2(g)+2NaOH(l)==2NaHCO3(l);ΔH=-(80x-20y) kJ/mol
难度: 简单查看答案及解析
-
综合下图判断,下列正确的说法是

A. 装置I和装置II中负极反应均是Fe-2e-=Fe2+
B. 装置I和装置II中正极反应均是O2+4e-+2H2O=== 4OH-
C. 装置I和装置II中盐桥中的阳离子均向右侧烧杯移动
D. 放电过程中,装置II右侧烧杯中溶液的pH增大
难度: 简单查看答案及解析
-
在容积固定的密闭容器中存在如下反应:A(g)+3B(g)
2C(g);△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

下列判断正确的是 ( )
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
难度: 简单查看答案及解析
-
对于平衡体系mA(g)+nB(g)
pC (g)+q(g);△H<0。下列结论中不正确的是( )
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
难度: 简单查看答案及解析
-
相同容积的4个密闭容器中进行同样的可逆反应:2A(g)+B(g)
3C(g)+2D(g),保持体积不变。起始时4个容器所装A、B的物质的量分别为:
在相同温度下建立平衡时,A或B的转化率大小关系为( )
A.A的转化率为:甲<乙<丙<丁 B.A的转化率为:甲<丙<乙<丁
C.B的转化率为:甲>乙>丙>丁 D.B的转化率为:丁>乙>丙>甲
难度: 简单查看答案及解析