-
在实验室中要使Al2(SO4)3溶液中的Al3+全部沉淀出来,最适宜的试剂是
A.NaOH溶液 B.氨水 C. Ba(OH)2溶液 D.盐酸
难度: 简单查看答案及解析
-
热化学方程式中化学式前面的计量数表示
A.分子个数 B.原子个数 C.物质的质量 D.物质的量
难度: 简单查看答案及解析
-
下列气态氢化物中最不稳定的是
A.PH3 B.NH3 C.H2O D.H2S
难度: 简单查看答案及解析
-
可逆反应2SO2(g)+O2(g)
2SO3(g)正在逆向进行时,正反应速率和逆反应速率的大小是
A. v正>v逆 B. v正< v逆 C. v正=v逆 D. 不能确定
难度: 简单查看答案及解析
-
用0.1026mol·L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为
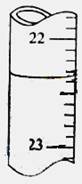
A. 22.30mL B. 22.35mL C. 23.65mL D. 23.70mL
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.N2的电子式:
B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子:
D. CO2的结构简式:O-C-O
难度: 简单查看答案及解析
-
常温下,将0.1 mol·L-1NaOH溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
A.1.7 B. 2.0 C. 12.0 D. 12.4
难度: 简单查看答案及解析
-
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI> Ag2CrO4 B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl
难度: 简单查看答案及解析
-
有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42- 的物质的量浓度为0.7 mol/L,则此溶液中K+的物质的量浓度为
A.0.1 B.0.15 C.0.2 D.0.25
难度: 简单查看答案及解析
-
.下列不能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定 ②HCl和H2S的水溶液前者的的酸性强 ③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S ⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.①③⑤
难度: 简单查看答案及解析
-
现有常温下的四份溶液:①0.01mol/LCH3COOH ②0.01mol/LHCl ③pH=12的氨水 ④pH=12的 NaOH溶液下列说法正确的是
A.①中水电离程度最小,③中水电离程度最大
B.将②③混合,若pH=7,则消耗溶液的体积:②﹥③
C.将四份溶液稀释相同倍数后,溶液的pH:③﹥④,②﹥①
D.将①、④混合,若有c(CH3COO-)﹥c(H+),则混合液一定呈碱性
难度: 简单查看答案及解析
-
室温下对pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A.中和两者,需要pH相等的相同体积的NaOH溶液
B.稀释两者相同倍数时,pH仍然相等
C.加适量的醋酸钠晶体后,两溶液的pH均增大
D.加足量的锌充分反应后,两溶液中产生的氢气一样多
难度: 简单查看答案及解析
-
100℃时向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列叙述不正确的是
A、此时水的离子积KW=1.0×10-14 B、水电离出的c(H+)=1.0×10-10mol/L
C、水的电离度随温度升高而升高 D、c(H3O+)>c(SO42-)
难度: 简单查看答案及解析
-
常温时,将V1mL c1mol·L-1的氨水滴加到V2mL c2moL·L-1的盐酸中,下列结论中正确的是
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则溶液中c (NH4+) = c (Cl-)
C.若混合溶液的pH=7,则溶液中c (NH4+)>c (Cl-)
D.若V1=V2,且混合液的pH<7,则可能有c1 = c2
难度: 简单查看答案及解析
-
下列说法正确的是
A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数;
B.AgCl的Ksp = 1.8×10-10,在任何含AgCl固体的溶液中,c(Ag+) = c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10;
C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液;
D.向饱和AgCl水溶液中加入盐酸,Ksp值变大。
难度: 简单查看答案及解析
-
在强酸溶液中存在大量的Fe2+和Ba2+,那么在溶液中含有的离子是
A NO3- B SO42- C Cl- D CO32-
难度: 简单查看答案及解析
-
关于如图所示装置的叙述,正确的是
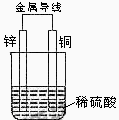
A. 铜是负极,铜片上有气泡产生
B. 铜片质量逐渐减少
C. 电流从锌片经导线流向铜片
D. 氢离子在铜片表面被还原
难度: 简单查看答案及解析
-
下列实验操作中正确的是:
A.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出
B. 用胶头滴管向试管滴加液体时,滴管尖端应紧靠试管内壁
C.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 简单查看答案及解析
-
“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是
A. 活化分子之间的碰撞一定是有效碰撞
B. 增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快
C. 对于有气体参加的反应增大压强,可使单位体积内活化分子增多,反应速率加快
D. 催化剂能降低分子的活化能,使单位体积内活化分子百分数大大增加
难度: 简单查看答案及解析
-
在某无色透明的酸性溶液中,能共存的离子组是
A.Na+ 、K+、SO42-、HCO3- B.Cu2+、K+、SO42-、NO3-
C.Na+、 K+、Cl-、 NO3- D.Fe3+、K+、SO42-、Cl-
难度: 简单查看答案及解析
-
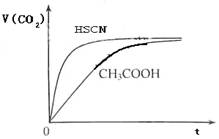
已知:HCN(aq)与NaOH(aq)反应的
;HCl(aq)与NaOH反应的
,则HCN在水溶液中电离的
等于
A.
B.- 43.5
C.+ 43.5
D.+ 67.7
难度: 简单查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的△H不同
难度: 简单查看答案及解析
-
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
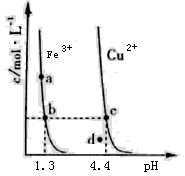
A.Ksp<Ksp2
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
难度: 简单查看答案及解析
-
下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐
B.pH = 4.5的番茄汁中c(H+)是pH = 6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH = 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-)
难度: 简单查看答案及解析
-
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A. c(H+) B. Ka(HF) C.
D.
难度: 简单查看答案及解析
-
在同温同压下,下列各组热化学方程式中 Q1 <Q2的是(反应条件已略去)
A.2H2(g) + O2(g) = 2H2O(g) ;△H=-Q1 , 2H2(g) + O2(g) = 2H2O(l) ;△H=-Q2
B.S(g) + O2(g) = SO2(g) ;△H=-Q1 , S(s) + O2(g) = SO2(g) ;△H=-Q2
C.C(s) + 1/2O2(g) = CO(g) ;△H=-Q1 , C(s) + O2(g) = CO2(g) ;△H=-Q2
D.H2(g) + Cl2(g) = 2HCl(g) ;△H=-Q1 , 1/2H2(g) + 1/2Cl2(g) = HCl(g) ;△H=-Q2
难度: 简单查看答案及解析
-
右图是298K 时N2与H2反应过程中能量变化的曲线图。下列叙述不正确的是
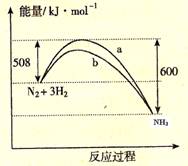
A. 该反应的热化学方程式为:N2(g) + 3H2(g)
2NH3(g), △H = -92kJ·mol-1
B. b曲线是加入催化剂时的能量变化曲线
C. 加入催化剂, 该化学反应的活化能和反应热都改变
D. 在温度体积一定的条件下, 通入lmol N2和3molH2 反应后放出的热量为Q1kJ, 若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ 则184>Q2 >2Q1
难度: 简单查看答案及解析
-
通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表是一些化学键的键能。
化学键
C—H
C—F
H—F
F—F
键能/(kJ·mol-1)
414
489
565
155
根据键能数据估算下列反应CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为
A.-1940kJ·mol-1 B.1940kJ·mol-1 C.-485kJ·mol-1 D.485kJ·mol-1
难度: 简单查看答案及解析
-
常温下,下列各组离子在制定溶液中一定能大量共存的是
A.1.0mol/L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
难度: 简单查看答案及解析
-
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A. 在自然界中只以化合态的形式存在 B. 单质常用作半导体材料和光导纤维
C. 最高价氧化物不与任何酸反应 D. 气态氢化物比甲烷稳定
难度: 简单查看答案及解析