-
设NA为阿伏伽德罗常数的值。下列有关叙述正确的是
A. 28 g乙烯和甲烷混合气体中的氢原子数为4NA
B. 标准状况下,11.2 LCH2Cl2含有的共价键数为2NA
C. 1mol SO2与 l mol O2反应生成的SO3分子数为NA
D. 过量铜与含0.4 molHNO3的浓硝酸反应,电子转移数大于0.2NA
难度: 中等查看答案及解析
-
W、X、Y、Z 是四种短周期非金属元素,原子序数依次增大, X、Y原子核外L电子层的电子数之比为3∶4,且Y的原子半径大于X的原子半径,X、Y、Z的最外层电子数之和为16,W的简单离子W-能与水反应生成单质w2。下列说法正确的是
A. 单质的沸点:X>Z B. X与W形成的化合物中只有极性键
C. 阴离子的还原性:W>X D. W、X、Y 可形成三元离子化合物
难度: 中等查看答案及解析
-
1mol酯R完全水解可得到l molC5H8O4和2mol甲醇,下列有关酯R的分子式和分子结构数目正确的是
A. C7H12O4,4种 B. C7H12O4,6种
C. C7H14O2,8 种 D. C7H14O2,10种
难度: 困难查看答案及解析
-
下列实验现象正确且实验操作能达到实验目的的是
实验操作
实验现象
实验目的
A
向待测液中滴加盐酸和稀硝酸
产生白色沉淀
检验待测液中是否含有Ag+
B
将含有少量CO2的CO气体緩缓通过足量的 过氧化钠粉末
淡黄色粉末变白
除去CO2,提纯CO
C
在Na2S溶液中滴加新制氯水
产生浅黄色沉淀
证明氯的非金属性比硫的强
D
在Ag2S浊液中滴加NaCl溶液
产生白色沉淀
比较Ag2S和AgCl的溶解度大小
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。下列有关该电池的说法错误的是

A. 电池工作时,Li+通过离子电子导体移向b区
B. 电流由X极通过外电路移向Y极
C. 正极发生的反应为:2H++2e-=H2↑
D. Y极每生成1 mol Cl2,a区得到2 mol LiCl
难度: 中等查看答案及解析
-
20mL 0.1000 mol•L-1氨水用0.1000 mol•L-1的盐酸滴定,滴定曲线入右下图,下列说法正确的是
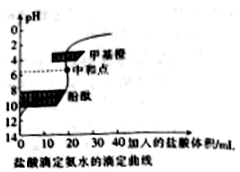
A. 该中和滴定适宜用酚酞作指示剂
B. 两者恰好中和时,溶液的pH=7
C. 达到滴定终点时,溶液中:c(H+)= c(OH-)+ c(NH3·H2O)
D. 当滴入盐酸达30mL时,溶液中c(NH4+)+c(H+)-)+c(Cl-)
难度: 中等查看答案及解析




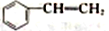 和CH2(COOH)2为原料(其他试剂任选),设计制备
和CH2(COOH)2为原料(其他试剂任选),设计制备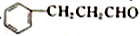 的合成路线[已知:
的合成路线[已知: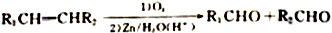 ]:_________________________________________________________。
]:_________________________________________________________。