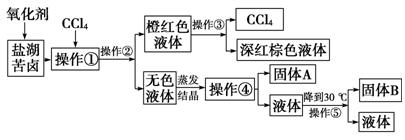
-
下列结论均出自《实验化学》中的实验,其中错误的是
A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘
B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据
C.镀锌铁皮发生电化学腐蚀时,锌发生氧化反应
D.食醋的总酸含量是指食醋中醋酸的总物质的量浓度
难度: 简单查看答案及解析
-
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法不正确的是
序号
被提纯的物质
除杂试剂
分离方法
A
碳酸氢钠粉末(Na2CO3)
H2O、CO2
加热结晶
B
氯化钾溶液(FeCl3)
氢氧化钾溶液
过滤
C
乙烷气体(乙烯)
溴水
洗气
D
二氧化碳(二氧化硫)
饱和NaHCO3溶液
洗气
难度: 简单查看答案及解析
-
以下关于纸层析的叙述,错误的是
A.纸层析法适用于分离和检验化学性质十分相近的分子或离子
B.用纸层析法可以检验氯化铁溶液中是否混有少量氯化铜
C.纸层析法是利用试样中各种离子随展开剂在滤纸上展开的速率不同而形成不同位置的色斑
D.为了看到色斑,只有有色离子的检验才可以用纸层析法
难度: 简单查看答案及解析
-
下列有关实验的说法不正确的是
A.当沉淀的颗粒较大时,也可用倾析法将固体和溶液分离
B.结晶时,若溶质的溶解度越大,或溶液的浓度越高、或溶剂的蒸发速度越快,析出的晶粒就越细小
C.利用硝酸和硝酸银溶液可区分工业盐和食盐
D.制备阿司匹林时可能混有少量的聚合物杂质,可用碳酸氢钠溶液进行提纯
难度: 简单查看答案及解析
-
下列说法不正确的是
A.用倾析法分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离
B.做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象
C.用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管
D.一旦金属汞洒落,必须尽可能收集起来,放在水中保存以防挥发;并将硫磺粉撒在洒落的地方,使金属汞转变成不挥发的硫化汞
难度: 简单查看答案及解析
-
用已知物质的量浓度的NaOH溶液滴定未知物质的量浓度的醋酸,下列判断滴定终点的方法正确的是
A.用酚酞作指示剂,滴定至溶液由无色变为红色,并在半分钟内不褪色
B.用甲基橙作指示剂,滴定至溶液由红色开始变为橙色
C.用石蕊作指示剂,滴定至溶液由红色开始变为紫色
D.在滴定过程中,用玻璃棒蘸取试液,涂抹在pH试纸上,至混合液pH为8
难度: 简单查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A、苯酚钠溶液中通入少量的SO2气体:2C6H5O—+SO2+H2O=2C6H5OH+SO32—
B、碘化亚铁中通入少量的氯气:2Fe2++Cl2=2Fe3++2Cl—
C、氯化铝中加入过量NaF:Al3++3F—=AlF3
D、溴乙A烷中滴入AgNO3溶液检验其中的溴元素:Br—+Ag+=AgBr↓
难度: 简单查看答案及解析
-
一定条件下,电解较稀的硫酸,其还原产物为双氧水,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2===O3+3H2O2。下列有关说法正确的是
A.电解池的阳极生成双氧水,阴极生成臭氧
B.电解池中硫酸溶液的pH保持不变
C.产生臭氧的电极反应式为3H2O-6e-===O3+6H+
D.产生双氧水的电极反应式为2H2O-2e-===H2O2+2H+
难度: 简单查看答案及解析
-
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的是
A.白色沉淀是CuI2,棕色溶液含有I2
B.滴加KI溶液时,转移1 mol电子时生成1 mol白色沉淀
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+> SO2> I2
难度: 简单查看答案及解析
-
下列说法正确的是
A、用重结晶法除去NaCl晶体中混有的少量KNO3时,将样品配成饱和溶液并放入蒸发皿中蒸发,当只剩下少量溶液时停止加热,利用余热蒸干
B、同温同压下,相同体积的0.1 mol▪L—1一元酸A和1 mol▪L—1一元酸B分别与总表面积相同的一定质量的锌粉反应时,发现前者放出H2的速率大,可以证明A的酸性大于B
C、准确度体现了测定结果的再现性,用偏差表示,偏差越小,说明测定的结果的准确度越高
D、碱石灰(NaOH和CaO的混合物)是一种实验室中常用的干燥剂,能用吸收水蒸气和二氧化碳,吸收过程中起主要作用的物质是CaO
难度: 简单查看答案及解析
-
为了检验新型镍催化剂在不同温度下对苯催化加氢的影响。其他条件相同,定时取样分析成分:
温度/℃
85
90
95
100
200
280
300
320
340
苯(mmol)
96.05
91.30
91.55
80.85
10
23.35
36.90
55.99
72.37
环己烷
(mmol)
3.95
8.7
8.45
19.15
90
76.65
63.10
44.01
27.63
(采用微型反应装置,压强为0.78 MPa,氢、苯物质的量之比为6.5∶1)
下列说法错误的是
A.随着反应温度的升高,苯的转化率先升高后降低
B.通过改变温度或压强不能使氢气和苯的转化率相同
C.调控压强与氢、苯物质的量之比可能有利于提高苯的转化率
D.当温度超过280 ℃,苯的转化率迅速下降,可能是因为该反应为吸热的可逆反应
难度: 简单查看答案及解析
-
在某一溶液中可能含有下列几种离子:K+、Fe3+、Ag+、Ba2+、AlO2—、CO32—、SO32—、SO42—。某该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同。
下列说法正确的是
A.气体甲可能为CO2或者SO2
B.沉淀丙中一定含有BaCO3,可能含有BaSO4
C.该溶液中肯定存在的离子有K+、AlO2—、SO32—、SO42—
D.只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定。
难度: 简单查看答案及解析
-
草酸晶体(H2C2O4·2H2O) 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)

难度: 简单查看答案及解析
-
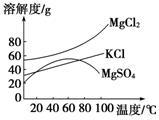
联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl。NaCl和NH4Cl共同存在时的溶解度曲线如下图所示,则正确的操作是

难度: 简单查看答案及解析
-
有四种燃料电池,A.固体氧化物燃料电池,B.碱性氢氧化物燃料电池,C.质子交换膜燃料电池,D.熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是
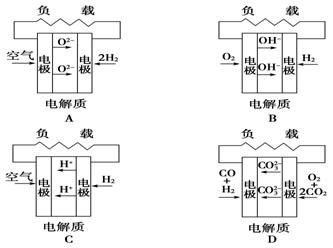
难度: 简单查看答案及解析
-
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)
I3- (aq)。上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。下列说法不正确的是
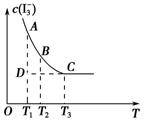
A.该反应的正反应是吸热反应
B.A点与C点的化学反应速率vA<vC
C.反应进行到D点时,v(正)>v(逆)
D.A点与B点相比,B点的c(I-)大
难度: 简单查看答案及解析
-
下列气体发生装置,当加入适当的块状固体和液体时不具有随开随关功能的是
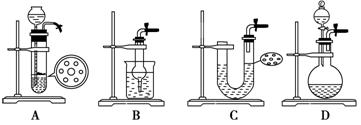
难度: 简单查看答案及解析
-
NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下:

关于NM-3和D-58的叙述,错误的是
A.都能与
溶液反应,原因不完全相同
B.都能与溴水反应,原因不完全相同
C.都不能发生消去反应,原因相同
D.遇
溶液都显色,原因相同
难度: 简单查看答案及解析