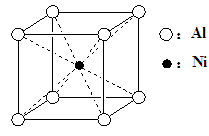
-
下列说法不正确的是
A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
C.现代常用红外光谱仪、核磁共振仪研究有机化合物的结构
D.MgO、Al2O3的熔点很高,工业上用于制作耐高温材料,也用于冶炼镁、铝金属
难度: 中等查看答案及解析
-
2010年诺贝尔化学奖授予“钯催化交叉偶联反应”的研究,采用钯催化可将碳原子连接在一起制造新的有机材料。下列说法不正确的是
A.钯催化剂能提高碳原子反应的活性
B.钯催化剂能催化所有类型的有机反应
C.“钯催化交叉偶联反应”有利于人类合成复杂分子
D.利用该技术能改变合成路径,降低反应发生的条件
难度: 中等查看答案及解析
-
氯化钠是一种重要的化工原料。下列表述中正确的是
A.NaCl的电子式为
B.电解熔融氯化钠可得到氯气和金属钠
C.23Na37Cl中质子数和中子数之比是8:7
D.由NaCl制备纯碱时发生了氧化还原反应
难度: 中等查看答案及解析
-
下列离子方程式表达正确的是
A.硫化钠的水解反应:S2—+2H2O
H2S+2OH—
B.铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
C.在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3-
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.常温下,1L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA
B.1mol羟基中电子数为10NA
C.在反应KIO3+6HI=KI+3H2O+3I2 中,每生成3mol I2转移的电子数为6NA
D.常温常压下,22.4L乙烯中C—H键数为4NA
难度: 中等查看答案及解析
-
滴加新制氯水后,下列各组离子可能大量存在的是
A.Fe3+、Al3+、Cl-、NO3- B.K+、Na+、I-、SO42-
C.Ag+、Ca2+、NH4+、NO3- D.Na+、Ba2+、CO32-、SO42-
难度: 中等查看答案及解析
-
下列有关实验原理或操作正确的是
A.将氯化镁溶液直接蒸发至干,可获得纯净的无水MgCl2固体
B.用二氧化锰和0.5mol/L盐酸混合加热,制取氧气
C.用KSCN溶液检验硫酸亚铁溶液是否氧化变质
D.用苯萃取溴的四氯化碳溶液中的溴
难度: 中等查看答案及解析
-
下列说法正确的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B.使用催化剂可以改变化学反应的反应热
C.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为氢氧化钠
D.反应2CO(g) =2C(s) + O2(g)
H>0可以自发进行
难度: 中等查看答案及解析
-
下列实验操作与预期目的或所得结论一致的是
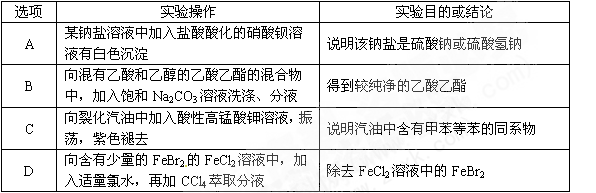
难度: 中等查看答案及解析
-
下列有关用水杨酸和乙酸酐制备阿司匹林(乙酰水杨酸)的说法中不正确的是
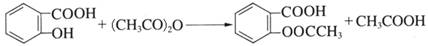
A.阿司匹林分子中有1个手性碳原子
B.水杨酸和阿司匹林都属于芳香族化合物
C.可用FeCl3溶液检验阿司匹林中是否含有未反应完的水杨酸
D.1 mol阿司匹林最多可与2 mol的NaOH溶液反应
难度: 中等查看答案及解析
-
常温下,向20 mL x mol·L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化)。下列说法中正确的是
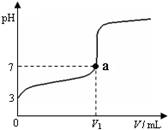
A.上述 CH3COOH溶液中:c(H+)=1×10-3 mol·L-1
B.图中V1 >20 mL
C.a点对应的溶液中:c (CH3COO-)=c (Na+)
D.当加入NaOH溶液的体积为20 mL时,溶液中:c (CH3COOH) + c (H+)>c (OH-)
难度: 中等查看答案及解析
-
我国新建的某海岛发电示意图如图,已知铅蓄电池放电时的总反应为:Pb+PbO2+2H2SO4 = 2PbSO4+2H2O,下列有关说法正确的是
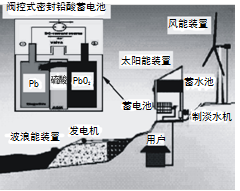
A.图中涉及的能量转化方式只有3种
B.蓄电池供电时,负极的电极反应为:Pb +SO42―-2e-=PbSO4
C.储能时若充电时间过长,阳极流向阴极的气体可能是H2
D.该发电工艺可实现零排放
难度: 中等查看答案及解析
-
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:CH2=CH2(g) + H2O(g)
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
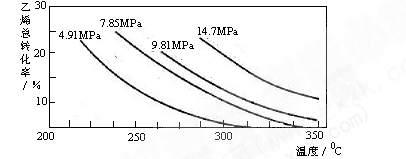
A.合成乙醇的反应一定为吸热反应
B.目前工业上采用250~300℃,主要是在此温度下乙烯的转化率最大
C.目前工业上采用加压条件(7MPa左右),目的是提高乙醇的产率和加快反应速率
D.相同催化剂下,在300℃ 14.7MPa乙醇产率反而比300℃ 7MPa低得多,是因为加压平衡向逆反应方向移动
难度: 中等查看答案及解析



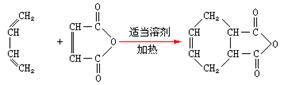 ,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子
,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子