-
(12分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤________________________________________________________________________。
⑥_______________________________________________________________________。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:_______________________________________________。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:______________________
_____________________________。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;
另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10−39)。
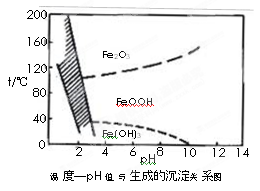
下列说法正确的是______________(选填序号)。
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10−29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:_____________
_________________________________________________________。
(5)补充上述步骤⑤和⑥【可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸】。
-
(12分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤▲ 。
⑥▲ 。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:▲ 。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:▲ 。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10−39)。下列说法正确的是▲ (选填序号)。
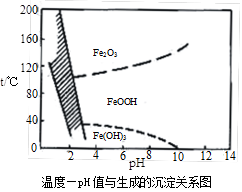
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10−29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钢,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:▲ 。
(5)补充上述步骤⑤和⑥(可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸)。
-
(12分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤____________________________________________________。
⑥_____________________________________________________________。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:_______________________________________。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:______________________
_____________________________。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;
另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10−39)。

下列说法正确的是______________(选填序号)。
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10−29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:_____________
_________________________________________________________。
(5)补充上述步骤⑤和⑥【可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸】。
-
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:

请回答下列问题:
(1)溶解废渣常用一定浓度的稀硫酸,用浓硫酸配制一定浓度的稀硫酸用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式: 。
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬。此外,除去铁还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp = 2.64×10−39)。下列说法正确的是______(选填序号)。
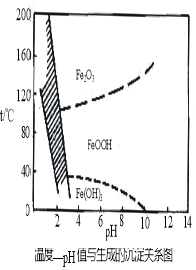
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10−27
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_________________。
(5)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是 。
(6)操作Ⅰ的实验步骤依次为:【实验中可选用的试剂:6mol•L-1的H2SO4溶液,蒸馏水、pH试纸】。
①__________________________________;
②__________________________________;
③ ;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干。
-
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤.
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤.
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬.
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀.
⑤______.
⑥______.
⑦蒸发、冷却结晶并从溶液中分离出晶体.
⑧用少量乙醇洗涤并凉干.
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:______.
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是______.
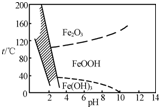
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH在2~4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去.右图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10-39).
下列说法正确的是______(选填序号).
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为6Fe2++Cl +6H+═6Fe3++Cl-+3H2O
+6H+═6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85℃~95℃生成黄铁矾钢,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是______.
(5)补充上述步骤⑤和⑥(可提供的试剂有6mol/L的H2SO4溶液、蒸馏水、pH试纸).
-
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等元素的化合物杂质)为原料获得。有关工艺流程如下:

(1)往废渣中加H2SO4酸漫,要充分搅拌,其目的是________。
(2)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式________。
(3)加6%的H2O2时,温度不能过高,其目的是________。
(4)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,用NaClO3氧化Fe2+的离子方程式为________。
(5)上述流程中滤液III的溶质的主要成分是:________。
(6)操作I包括以下过程:过滤,用H2SO4溶解,________、________、过滤、洗涤获得产品。
-
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣( 除含镍外,还含有Cu、Zn、Fe 等杂质) 为原料获得。有关工艺流程如下:
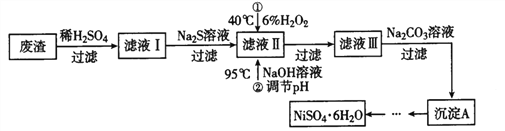
注:(1)NiCO3 是一种不溶于水、易溶于强酸的浅绿色沉淀。
(2)25℃,Ksp[Fe(OH)3]=2.64×10-39;溶液中离子浓度小于10-5mol·L-1,可视为沉淀完全。
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_________________。(任写一点)
(2)在滤液Ⅱ中加入H2O2 时,温度不能太高的原因是______________________。
(3)滤液Ⅲ中溶质的主要成分是__________________ ,检验滤液Ⅲ中是否还有铁元素的方法是_______________________。
(4)除铁时还常用NaClO3作氧化剂,在较小的pH 条件下最终生成一种浅黄色的黄铁矾钠 [Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH 与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法正确的是__________________(选填序号)。
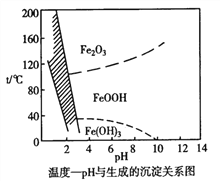
a.FeOOH 中铁为+2价
b.若在25℃时,用H2O2 氧化Fe2+,再在pH=4 时除去铁,此时溶液中c(Fe3+)=2.64×10-27mol·L-1
c.用氯酸钠在酸性条件下氧化Fe2+ 离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH 为1.5左右
(5)从“沉淀A”制得NiSO4·6H2O晶体的实验步骤依次为:_________________,用少量乙醇洗涤NiSO4·6H2O晶体并晾干。(实验中须使用的试剂有:6mol·L-1的H2SO4 溶液,蒸馏水)
-
(10分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可以电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:

请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取速率可采取的措施有____________(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:_________________。
(3)上述流程中滤液Ⅲ的主要成分是____________。
(4)确定步骤四中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是___________。
(5)操作Ⅰ的实验步骤依次为(实验中可选用的试剂:6mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①_________________________;
②_________________________;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体;
④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
-
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
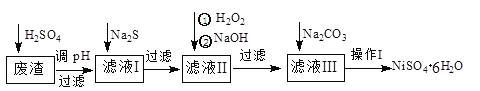
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_________________(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:____________________________________________。
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬。此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25℃时,Fe(OH)3的Ksp=2.64×10-39]。
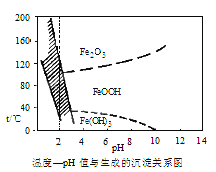
下列说法正确的是(选填序号)_______。
a. FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.6×10-29mol·L-1
c.用氯酸钠在酸性条件下氧化Fe2+的离子方程式为6Fe2++C1O3-+6H+=6Fe3++C1-+3H2O
d.工业生产中常保持在85~95℃生成黄铁钒钠,此时水体的pH约为3
(4)上述流程中滤液I的主要成分是___________。
(5)操作I的实验步骤依次为(实验中可选用的试剂:6mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①___________;②___________;③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体:④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
-
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
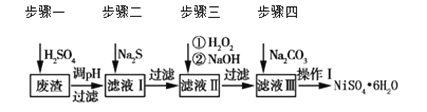
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_______(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式________。

(3)在40 ℃左右,用6%的H2O2氧化Fe2+,再在95 ℃时加入NaOH调节pH,除去铁和铬。此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠 (OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是_______(选填序号)。
(OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是_______(选填序号)。
a.FeOOH中铁为+2价
b.若在25 ℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+的离子方程式为:6Fe2++Cl +6H+
+6H+ 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95 ℃生成黄铁矾钠,此时水体的pH为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_______。
(5)确定步骤四中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是_______。
(6)操作Ⅰ的实验步骤依次为(实验中可选用的试剂:6 mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①___________;
②___________;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体;
④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。













