-
连二亚硫酸钠(Na2S2O4)又称保险粉,在纺织行业中常用于还原染色剂。
己知连二亚硫酸钠具有下列性质:在空气中极易被氧化,不溶于甲醇,易溶于水,遇水迅速分解为亚硫酸氢钠和硫代硫酸钠,在碱性介质中较稳定。回答下列问题:
(1)二氧化硫的制备
原料:亚硫酸钠固体和70%的浓硫酸
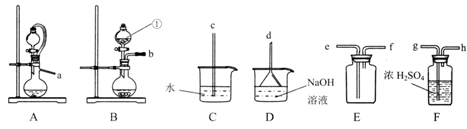
(1)仪器①的名称是_______________。
(2)实验室制取干燥二氧化硫的装置连接顺序为______(选择上图中部分仪器,按气流方向用小写字毋排序),选择该气体发生装置的原因是________________。
(3)设计实验证明二氧化硫具有还原性_______(实验中可选用的试剂有:品红溶液、氢硫酸、溴水,滴有酚酞的氢氧化钠溶液)
(二)保险粉的制备
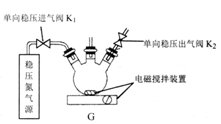
I.在G装置中加入甲酸钠浓溶液、氢氧化钠,甲醇(溶剂)的混合液;
II:打开K1、K2,一段时间后,向装置中通入二氧化硫;
III.加热一段时间,装置中有黄色晶体析出,并产生大量气体;
IV.过滤、洗涤、干燥,收集产品。
(1)写出步骤II中制备保险粉的化学方程式____________。
(2)简述步骤IV保险粉的洗涤方法:在无氧环境中,_________________。
(3) 步骤IV干燥保险粉的最佳方法为________(选填序号)。
A.空气中蒸发干燥 B.氯化氢气流中蒸发干燥 C.真空干燥
(三)保险粉的含量测定
铁氰化物滴定法原理是:4K3[Fe(CN)6]+2Na2S2O4+8KOH=3K4[Fe(CN)6]+4Na2SO3+Na4[Fe(CN)6]+4H2O
I.另取一套G装置,加入一定体积的氢氧化钠溶液,通入N2;
II.称取样品mg加入装置G中搅拌,溶解,再加入2-3滴亚甲基蓝指示剂;
III.用浓度为cmol·L-1的K3[Fe(CN)6]滴定,至滴定终点时,记录消耗的体积为VmL。
保险粉质量分数表达式为__________(用含c、m、V的代数式表示)。
(2)若在滴定前未向锥形瓶中通氮气,则会导致测定的保险粉含量______(填“偏高”、“偏低”或“无影响”)
-
汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应。
(一)已知:反应l: N2(g)+O2(g)=2NO(g) △H1 K1
反应2: CO(g)+ 1/2O2(g)=CO2 (g) △H2 K2
反应3: 2NO(g)+2C0(g)=N2(g)+CO2(g) △H3 K3
则反应3的焓变△H3=_______(用△H1和△H2表示) 平衡常数K3=_____(用K1和K2表示)。
(二)向1.0L恒容密闭容器中,充入N2O(g)和C0(g),可发生如下反应:
N2O(g)+C0(g)  N2(g)+CO2(g),所得实验数据如下表:
N2(g)+CO2(g),所得实验数据如下表:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol |
| n(N2O) | n(CO) | n(CO2) |
| ① | 400 | 0.20 | 0.30 | 0.14 |
| ② | 500 | 0.10 | 0.40 | 0.080 |
| ③ | 500 | 0.30 | 0.20 | A |
| ④ | 600 | 0.60 | 0.40 | B |
| | | | |
上述实验编号①中,若10min时测得n(N2)=0.12mol,则0至10min内,用CO2表示的平均反应速率以v(CO2)=________;
(2)500℃时,欲使N2O的平衡转化率a(N2O)≥80%,则起始时n(N2O):n(CO)≤______。
(3)上述实验编号④达平衡时,b____0.24(填“>”、“<”或“=”),原因是_______。
(4) N2O(g)+C0(g) N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:
N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:
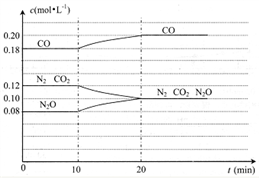
①若在第10min仅改变了一个条件,第20min时是在新条件下达到新的平衡状态,则第10min 时改变的条件可能是_______;
②比较CO在第5min和第25min时速率的大小v(5)____v(25)(填”>”、“<”或“= ”),你判断的理由是______________。
-
“海绵镍铝催化剂” 是一种多孔的镍铝合金,常用作有机催化剂。现以某粗镍(含Ni、Fe、Cu及难与酸、碱溶液反应的不溶性杂质)为原料制取该催化剂,主要流程如下:

己知:25℃时,以0.1mol/L金属离子测定得到如下数据:
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 |
| Ksp | 6×10-36 | | | 3×10-19 | |
| pH | 开始沉淀 | | 4.7 | 7.2 | | 1.9 |
| 沉淀完全 | | 6.7 | 9.2 | | 3.2 |
| | | | | | |
根据信息回答:
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式__________。
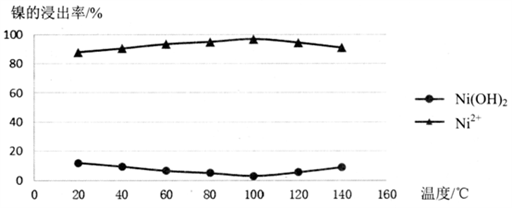
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是______________。
(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物。为达到此目的,应先加NaOH将溶液调节至_______(填pH的取值范围);再加_______(选填最佳试剂的序号)。当溶液中Ni2+开始形成NiS时,c(Cu2+)_______。(忽略溶液体积变化)
A.硝酸 B.氨水 C. A12S3 D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为______;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni。ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为_____________。
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为___________________。
-
【化学-选修3:物质结构与性质】
南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
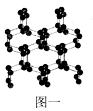
(1)N、O、F三种元素的第一电离能由大到小的顺序为____(填元素符号);与N2互为等电子体的全氧离子化学式为_______;具有空间网状结构的高聚氮结构如图一所示,则N70的沸点_____(填“>”、“<”或“=”)高聚氮的沸点,原因是_________________;N70和高聚氮属于_____(选填序号)。
A.同素异形体 B.同分异构体 C.同位素 D.同系物
(2)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3) 等。叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钴显____价,它的配体是____,SO42-的立体构型为___________。
(3)HN3是一种全氮阴离子酸,可由肼(N2H4)被HNO2氧化制得。下列说法正确的是____。
A.酸性:HNO2>HNO2
B. N2H4分子中N原子均采取sp3杂化
C. NaN3的晶格能小于KN3的晶格能
D.上述生成氢叠氮酸的化学方程式为N2H4+HNO2=2H2O+HN3
(4)N8是一种由全氮阳离子和全氮阴离子构成的特殊物质,已知阳离子由5个氮原子排列成V 形,每个氮原子均达到八电子稳定结构,则阳离子的电子式为_______。
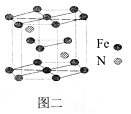
(5)一种氮铁化合物的结构如图二所示,若图中六棱柱的体积为Vcm3, 用NA表示阿伏加德罗常数的值,则该晶体的密度为______。
-
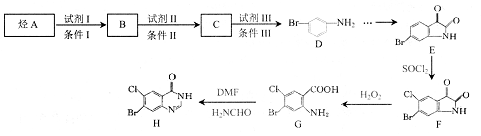
有机物H是药物常山酮的合成中间体,合成H的流程图如下:
已知:① 苯环上原有取代基对新导入苯环上的取代基位置有一定影响,其规律如下:
-OH、-CH3、-Br等取代基使新导入的取代基主要进入原取代基邻位和对位;
-NO2、-SO3H、-CHO等取代基使新导入的取代基主要进入原取代基间位。
② (-NH2易被氧化)
(-NH2易被氧化)
③ 甲苯可被酸性高锰酸钾氧化为苯甲酸
回答下列问题:
(1)D中的官能团名称为_________。
(2)E→F的反应类型为__________。
(3)B→C的化学反应方程式为___________。
(4)G在一定条件下能发生缩聚反应,该反应方程式为__________。
(5)W与B是同系物,W与B的最大质荷比相差14,同时满足下列条件的W的同分异构体有_______种。
① 能与NaOH溶液反应 ② 苯环上有两个取代基 ③ 遇氯化铁溶液不显色
其中核磁共振氢谱显示为4组峰,且峰面积比为1:2:2:2的所有物质的结构简式是______。
(6)写出以甲苯为原料合成 的流程图(无机试剂任用)_______
的流程图(无机试剂任用)_______

3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述错误的是
的变化如图所示,下列说法正确的是

D. 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)> c(Na+)>c(H+)>c(OH-)








 (-NH2易被氧化)
(-NH2易被氧化)