-
汽车尾气中的污染物有固体悬浮颗粒、一氧化碳、碳氢化合物、氮氧化合物铅及硫氧化合物等。下列说法中正确的是
A. 固体悬浮颗粒是造成雾霾天气的一种重要因索
B. 一氧化碳、氮氧化合物是酸雨形成的主要因素
C. 硫氧化合物不仅能形成酸雨,还能形成光化学烟雾
D. 汽车尾气可通过净化装置将碳氢化合物还原成CO2和H2O
难度: 简单查看答案及解析
-
化学学科需要值助化学语言来描述。下列化学用语正确的是
A. CCl4分子的比例模型:
 B. NH4I的电子式:
B. NH4I的电子式: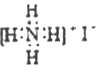
C. S2-的结构示意图:
 D. 乙醇的结构简式:C2H6O
D. 乙醇的结构简式:C2H6O难度: 简单查看答案及解析
-
下列说法正确的是
A. 石墨和金刚石互为同素异形体
B.
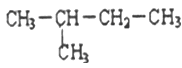 与
与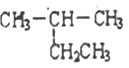 互为同分异构体
互为同分异构体C. H2O、D2O、T2O互为同位素
D. CH3OH和 HOCH2CH2OH互为同系物
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 二氧化锰具有较强的氧化性,可作H2O2分解的氧化剂
B. 铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁
C. AlCl3是电解质,可电解熔融AlCl3制铝
D. 油脂能在碱性条件下水解,可用于工业上制取肥皂
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的短周期主族元素,X是最外层只有一个电子的非金属元素,Y是地壳中含量最高的元素,W的原子序数是Y的2倍, X、Y、Z、W的最外层电子数之和为15。下列说法正确的是
A. X和Y只能形成一种化合物 B. 简单离子半径:W2->Y2->Z2+
C. 简单气态氢化物的热稳定性:W>Y D. WY2、ZY中化学键类型相同
难度: 中等查看答案及解析
-
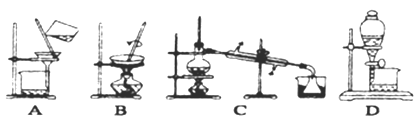
下列装置或操作能达到实验目的的是
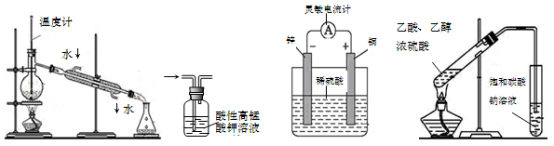
A. 蒸馏石油 B. 除去甲烷中少量乙烯 C. 验证化学能转变电能 D. 制取乙酸乙酯
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,且在反应过程中能量的变化如下图所示的是
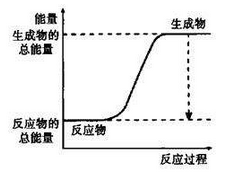
A. Mg+2HCl=MgCI2+H2↑
B. 2NH4Cl+Ba(OH)2•8H2O=BaCl2+2NH3↑+10H2O
C. H2SO4+2NaOH==Na2SO4+2H2O
D. C+CO2
2CO
难度: 简单查看答案及解析
-
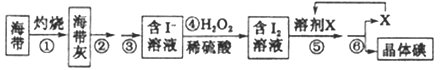
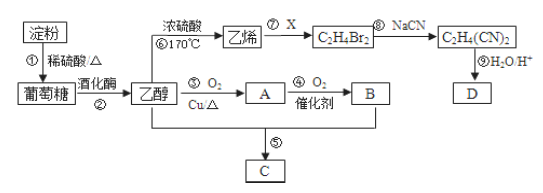
给定条件下,下列选项中所示的物质间转化,均能一步实现的是
①SO2
(NH4)2SO3
(NH4)2SO4
②煤
焦炭
 (CO+H2)
(CO+H2)  CH3OH
CH3OH③C4H10
 C2H4
C2H4
④(C6H10O5)n(淀粉)
 C6H12O6(葡萄糖)
C6H12O6(葡萄糖)C2H5OH
A. ①②③④ B. ①③④ C. ③④ D. ①②
难度: 简单查看答案及解析
-
以下反应最符舍绿色化学原子经济性要求的是
A. 甲烷与氯气反应制取四氯化碳
B. 氯乙烯加聚制取聚氯乙烯高分子材料
C. 以铜和浓硫酸为原料制取硫酸铜
D. 苯和浓硝酸、浓硫酸的混合物在一定条件下反应制取硝基苯
难度: 中等查看答案及解析
-
“直接煤燃料电池"能够将煤中的化学能高效、清洁地转化为电能,下图是用固体氧化物作“直接煤燃料电池”的电解质。有关说法正确的是
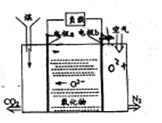
A. 电极b为电池的负极
B. 电子由电极a沿导线流向b
C. 电池反应为:C+CO2=2CO
D. 煤燃料电池比煤直接燃烧发电能量利用率低
难度: 中等查看答案及解析
-
膳食纤维具有突出的保健功能,人体的“第七营养素”木质索是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是
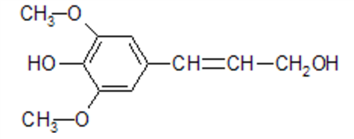
A. 芥子醇的分子式是C11H14O4,属于芳香烃
B. 1mol芥子醇最多可与3molH2加成
C. 芥子醇分子中可能所有原子都共面
D. 芥子醇能发生的反应类型有氧化、取代、加成、加聚
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 15g甲基(CH3-)中含有电子的数目为10mol
B. 煤的干馏和石油的分馏都是化学变化
C. 可用溴水鉴别四氯化碳和己烷两种无色液体
D. 苯既不能使溴水褪色也不能使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
下列根据实验操作和现象所得到的结论正确的
选项
实验操作和现象
结论
A
向Na2SiO3溶液中滴加盐酸,产生H2SiO3胶体
非金属性:Cl >Si
B
—支试管中加入2mL5%的H2O2溶液和lmL蒸馏水,另一支试管中加入2mL5%的H2O2溶液和lmol/LFeCl3溶液,第二支试管中产生气泡的速度快
FeCl3可以加快H2O2分解的反应速率
C
将绿豆大小的钠分别加入到水和乙醇中,乙醇与钠的反应比水与钠的反应平缓得多
乙酵羟基中的氯原子不如水分子中的氢原子活泼
D
蔗糖与稀硫酸混和加热一段时间,冷却后滴加新制备的银氨溶液并水浴加热,无银镜出现
蔗糖没有水解
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
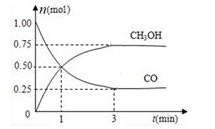
对于可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系是:2v正(NH3)=3v正(H2O)
难度: 简单查看答案及解析
-
在一定条件下进行反应:COCl2(g)
Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0molCOCl2(g),反应过程中测得的有关数据见下表:
t/s
0
2
4
6
8
n(Cl2)/mol
0
0.30
0.39
0.40
0.40
下列说法不正确的是
A. 生成Cl2的平均反应速率:0~2s比2~4s快
B. 0~2s COCl2的平均分解速率为 0.15mol • L-1·s-1
C. 6s时,反应达到最大限度
D. 该条件下,COCl2的最大转化率为60%
难度: 中等查看答案及解析
 2H2↑+O2↑
2H2↑+O2↑