-
2000年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首.猴首和虎首.普通铜器时间稍久容易出现铜绿,其主要成分是[Cu2(OH)2CO3].这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是( )
A.它们的表面都镀上了一层耐腐蚀的黄金
B.环境污染日趋严重,它们的表面铜绿被酸雨溶解洗去
C.铜的金属活动性比氢小,因此不易被氧化
D.它们是含一定比例金.银.锡.锌的铜合金难度: 中等查看答案及解析
-
下列实验中,仪器的下端必须插入液面下的是( )
①制备氢气的简易装置中的长颈漏斗; ②制备氯气装置中的分液漏斗;
③制备Fe(OH)2操作中的胶头滴管; ④将氯化氢气体溶于水时的导管
⑤用乙醇制取乙烯时的温度计; ⑥分馏石油时的温度计.
A.①③④⑤
B.②④⑥
C.①③⑤
D.全部难度: 中等查看答案及解析
-
人们把食品分为绿色食品,海洋食品.白色食品.蓝色食品等.绿色植物通过光合作用转化的食品叫绿色食品,海洋提供的食品叫蓝色食品;通过微生物发酵得到的食品叫白色食品.下面属于白色食品的是( )
A.食醋
B.面粉
C.海带
D.菜油难度: 中等查看答案及解析
-
以下关于纸上层析的叙述,错误的是( )
A.纸上层析法适用于分离和检验化学性质十分相近的分子或离子
B.纸上层析法分为上升纸层析法和径向纸层析法
C.纸上层析法是利用试样中各种离子随展开剂在滤纸上展开的速率不同而形成不同位置的色斑
D.为了看到色斑,只有有色离子的检验才可以用纸上层析法难度: 中等查看答案及解析
-
下列说法不符合人与自然和谐相处的是( )
A.对农作物合理施用化肥
B.将塑料垃圾埋入地下或倾倒入海
C.对废旧电池进行回收处理
D.使用沼气、太阳能、风能等代替煤炭难度: 中等查看答案及解析
-
下列属于人类的营养物质,而不是高分子化合物的是( )
A.脂肪
B.淀粉
C.蛋白质
D.纤维素难度: 中等查看答案及解析
-
人类认识原子结构的历史中,科学家汤姆孙作出的重要贡献是( )
A.创立了近代原子论
B.提出了原子结构的行星模型
C.创立了现代原子论
D.提出了葡萄干面包模型难度: 中等查看答案及解析
-
有关化学用语正确的是( )
A.乙烯的最简式C2H4
B.乙醇的结构简式C2H6O
C.四氯化碳的电子式
D.硫离子的核外电子排布式1s22s22p63s23p6难度: 中等查看答案及解析
-
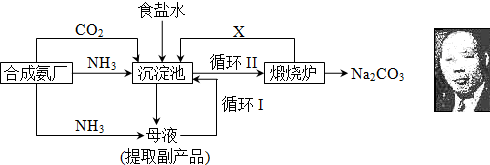
以下叙述错误的是( )
A.CO可作冶铁的还原剂
B.空气或氧气可作炼钢的氧化剂
C.一定条件下,用H2或CO可将钙从CaO中还原出来
D.侯德榜制碱法得到的产品是纯碱和氯化铵难度: 中等查看答案及解析
-
下列变化一定不可逆的是( )
A.溶解
B.水解
C.电解
D.电离难度: 中等查看答案及解析
-
下列用来表示物质变化的化学用语中,错误的是( )
A.小苏打在水中的电离方程式:NaHCO3→Na++H++CO32-
B.明矾水解的离子方程式:Al3++3H2OAl(OH)3+3H+
C.钢铁腐蚀时负极发生的反应:Fe-2e→Fe2+
D.氢气燃烧生成液态水的热化学方程式:2H2(g)+O2(g)→2H2O(l)+571.6kJ难度: 中等查看答案及解析
-
如图所示,X.Y都是石墨电极,a是饱和食盐水,实验开始时,同时在U型管的两边各滴入几滴酚酞试液,下列叙述正确的是 ( )

A.Y是阳极,该电极附近有无色气体产生
B.电解时电能将转变为化学能
C.X是负极,该电极附近先观察到溶液变红色
D.电解一段时间收集产生的气体,Y电极得到气体体积稍大难度: 中等查看答案及解析
-
在两种短周期元素组成的化合物中,若它们的原子个数之比为1:3,设这两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是( )
①a=b+4 ②a+b=8 ③a+b=30 ④a=b+8 ⑤a=b+5.
A.只有②③⑤
B.只有①②③④
C.只有①④⑤
D.①②③④⑤难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.氢氧化钡溶液中滴加硫酸氢钠至中性:Ba2++OH-+H++SO42-→BaSO4↓+H2O
B.饱和碳酸钠溶液中通入二氧化碳后溶液变浑浊:2Na++CO32-+CO2+H2O→2NaHCO3↓
C.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-→CO32-+H2O
D.5.6gFe与200mL2.0mol/LHNO3溶液充分反应:3Fe+2NO3-+8H+→3Fe2++2NO↑+4H2O难度: 中等查看答案及解析
-
下列装置或操作能达到实验目的是( )
A.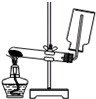
实验室制取并收集氨气
B.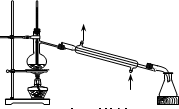
无水乙醇的制取
C.
检查装置的气密性
D.
利用排空气法收集二氧化碳难度: 中等查看答案及解析
-
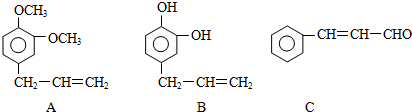
一种兴奋剂X的结构如图所示.下列说法的错误是( )

A.一定条件下,1mol X与足量NaOH溶液反应,最多可消耗4mol NaOH
B.1mol X与足量浓溴水反应,最多消耗4mol Br2
C.X遇FeCl3溶液显紫色
D.分子中含有苯环.碳碳双键.氯原子.羟基四种官能团难度: 中等查看答案及解析
-
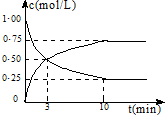
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32¯)、c(HCO3¯)都减少,其方法是( )
A.通入二氧化碳气体
B.加入氢氧化钠固体
C.通入氯化氢气体
D.加入饱和石灰水溶液难度: 中等查看答案及解析
-
已知亚磷酸(H3PO3)只能生成两种钠盐(NaH2PO3和Na2HPO3),由此可知不正确的说法是( )
A.亚磷酸中磷呈+3价
B.亚磷酸有氧化性和还原性
C.亚磷酸是三元酸
D.亚磷酸只形成两种酸式盐而无正盐难度: 中等查看答案及解析
-
以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是( )
A.
B.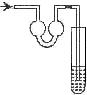
C.
D.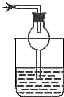
难度: 中等查看答案及解析
-
X、Y、Z三种非金属,原子最外层电子数相等.等物质的量的单质X2、Y2、Z2分别与足量钠反应时放热,反应热分别为Q1.Q2.Q3,且Q1>Q2>Q3,下列判断一定正确的是( )
A.气态氢化物的沸点HX>HY>HZ
B.最高价氧化物的水化物酸性HXO4>HYO4>HZO4
C.气态氢化物的稳定住HX<HY<HZ
D.原子半径X<Y<Z难度: 中等查看答案及解析
-
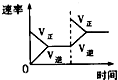
对于可逆反应N2(g)+3H2(g)⇌2NH3(g)+Q;Q>0,下列研究目的和示意图相符的是 ( )
A B C D 研究目的 压强对反应的影响(P2>P1) 温度对反应的影响 平衡体系增加N2对反应的影响 催化剂对反应的影响 图示 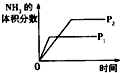


A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
今有一混合物的水溶液,只可能含有以下离子中的若干种:NH4+、Cl-、Mg2+、Ba2+、K+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
A.K+一定存在
B.该溶液中含CO32-离子的浓度为0.1mol/L
C.Cl-可能存在
D.Ba2+一定不存在,Mg2+可能存在难度: 中等查看答案及解析