-
自然界中存在的碘的稳定性核素是碘-127(
I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131(
I)。碘-131 (
I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是( )
A.
I2和
I2互为同素异形体 B.
I和
I互为同位素
C.
I的摩尔质量为131 D.
I中子数与质子数之差为74
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.CO2的电子式:
B.次氯酸的电子式:
C.CH4分子的比例模型:
D.Cl-的结构示意图:
难度: 中等查看答案及解析
-
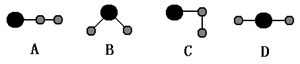
下列各表中数字(表示原子序数)所表示的元素与它们在周期表中位置相符的一组是( )[

难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
B.向煤中加入生石灰可减少对大气的污染
C.完全由非金属元素组成的化合物可以形成离子化合物
D.由氮气为原料合成氨是氮的固定
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,NA个NO分子和0.5 NA个O2分子混合后气体的总体积为33.6 L
B.10g D2O晶体中含有的氢氧键数目为NA
C.标准状况下,1 mol SO3分子体积约为22.4 L
D.常温常压下,1 mol氦气含有的核外电子数为4 NA
难度: 中等查看答案及解析
-
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
难度: 中等查看答案及解析
-
1克氢气燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g)=2H2O(l); △H=-285.8 kJ/mol
B.H2(g)+1/2O2(g)=H2O(g);△H=-142.9kJ/mol
C.H2O(l)=H2(g)+1/2O2(g); △H=+285.8 kJ/mol
D.2H2+O2=2H2O; △H=-571.6 kJ/mol
难度: 中等查看答案及解析
-
X、Y是原子序数大于4的两种主族元素,它们的离子Xm+ 和Yn- 具有相同的核外电子排布。有关X、Y的叙述不正确的是( )
A.原子序数大小:X>Y
B.Xm+ 和Yn-离子半径大小:Yn-<Xm+
C.在周期表中X、Y在不同周期
D.在周期表中X、Y的族序数之差为:8-(m+n)
难度: 中等查看答案及解析
-
下列分子中所有原子全部满足最外层为8个电子结构的是( )
A.PCl5 B.NH3 C.PCl3 D.BF3
难度: 中等查看答案及解析
-
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且将a、b相连浸入稀硫酸中时,a溶解而b表面有气泡产生;c和d的气态氢化物的还原性d>c,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是( )
A.a、b、e、d、c B.e、d、a、b、c
C.b、a、e、d、c D.a、b、d、c、e
难度: 中等查看答案及解析
-
北京大学和中国科学院的化学工作者最近研制出碱金属与C60形成的球碳盐K3C60, 实验测知该物质属于离子晶体,且有良好的超导性,下列K3C60的组成和结构分析正确的是( )
A.该物质分子式为K3C60
B.K3C60的摩尔质量是837
C.1molK3C60中含有的离子键的数目为63×6.02×1023个
D. K3C60中既有离子键 ,又有共价键 ,在熔融状态下能导电
难度: 中等查看答案及解析
-
现有如下各说法:( )
①在水分子中氢、氧原子间以共价键相结合;
②活泼金属和活泼非金属化合时一般形成离子键;
③非金属元素间形成的化合物一定是共价化合物;
④根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键;
⑤冰的密度比水的密度小,这与氢键有关;
上述各种说法正确的是
A.①②⑤ B.①②④⑤ C.①②③④⑤ D.①③④⑤
难度: 中等查看答案及解析
-
下列有关元素周期表、元素周期律的说法中不正确的是:( )
A.已知Sr元素位于第五周期IIA族,故Sr(OH)2碱性比Mg(OH)2弱
B.己知As元素位于第四周期VA族,故NH3比 AsH3稳定
C.元素周期表分为7个主族、7个副族、1个0族、1个VIII族,共18个纵行
D.副族元素中没有非金属元素
难度: 中等查看答案及解析
-
下列离子中,所带电荷数与该离子的核外电子层数相等的是:( )
A.Mg2+ B.Al3+ C.Be2+ D.H+
难度: 中等查看答案及解析
-
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是( )
A.C(s、石墨)=C(s、金刚石) △H=+1.9 kJ•mol-1
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
难度: 中等查看答案及解析
-
关于右图装置的叙述,正确的是( )

A.铝是负极,铝片上析出无色气体
B.溶液中两电极间产生白色沉淀
C.溶液中先产生白色沉淀,最后沉淀溶解
D.石墨是正极,石墨棒上析出黄绿色气体
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是:( )
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
难度: 中等查看答案及解析
-
工业废气中氮氧化物是造成污染的主要来源之一.为了防治污染,工业上常通入氨气与氮氧化物反应:NOx+NH3→N2+H2O.现有NO、NO2的混合气体3L,可用同温同压下的NH3 3.5L恰好与它完全反应生成N2。则原混合气体中NO和NO2的物质的量之比为( )
A.1∶1 B.1∶3 C.2∶1 D.1∶4
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g • L
1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是( )
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由Y、Z、M三种元素形成的化合物一定只有共价键
难度: 困难查看答案及解析
-
已知C2H2(g)+ 5/2 O2(g)=2CO2(g) + H2O(l) △H=-1300kJ·mol-1,则下列说法正确的是( )
A.当有20NA个电子转移时,放出2600kJ 热量
B.当有4NA个碳氧共用电子对生成时,放出1300kJ热量
C.若生成NA个水蒸气分子焓变为△H0,则△H0<△H
D.上述反应为吸热反应
难度: 中等查看答案及解析
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2+H2O+2e—→Mn2O3+2OH—
C.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g[
D.电池工作时,电子由负极通过电解液流向正极
难度: 中等查看答案及解析
-
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是( )
A.反应过程中能量关系可用下图表示

B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池则锌为负极
D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
难度: 中等查看答案及解析
-
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
A.通CO的一极是电池的正极
B.该电池工作过程中需不断补充CO和O2,CO2可循环利用
C.负极反应式为:O2+2CO2+4e-→2CO32-
D.正极反应式为:2CO+2CO32-→4CO2+4e-
难度: 中等查看答案及解析
-
某工业废水含有下列离子中的5种,K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,且各种离子的物质的量浓度相等。甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是:( )
A.溶液中难以确定Al3+的存在与否
B.原溶液中所含的离子为:Cu2+、Fe2+、Cl-、NO3-、SO42-
C.步骤②中可以确定Fe2+、NO3-的存在,不能确定其它离子的存在
D.步骤③中的白色沉淀为2种钡盐
难度: 困难查看答案及解析