-
为纪念化学对社会进步和人类文明的贡献,联合国将2011年定为“国际化学年”.下列说法不正确的是( )
A.合成药物的研发和使用,保障了人体健康
B.新材料的研制和应用,提高了人们的生活品质
C.化石燃料的直接利用,促进了低碳经济的发展
D.化肥的合理使用提高了农作物产量,缓解了人类粮食危机难度: 中等查看答案及解析
-
推理是化学学习中常用的思维方法.下列推理正确的是( )
A.氧化物中都含有氧元素,所以含氧元素的化合物一定是氧化物
B.NaOH溶液中的OH-能与酸反应,则KOH溶液中的OH-也能与酸反应
C.饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质
D.盐是由金属离子和酸根离子组成的,NH4NO3中没有金属离子,不属于盐难度: 中等查看答案及解析
-
我省从今年3月20日起,统一发布PM2.5检测数据.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,他们直径小,富含大量有害物质,且在大气中停留时间长,对人体健康影响很大.下列情况不会增加空气中PM2.5的是( )
A.露天焚烧秸秆
B.利用太阳能发电
C.汽车排放尾气
D.直接用煤作燃料难度: 中等查看答案及解析
-
常温下,将下列各组中的物质各5g分别放入盛有100g水的烧杯中,充分搅拌,产生的现象最相似的一组是( )
A.CaO NaCl
B.CaCO3 BaCO3
C.FeCl2 CaCl2
D.NaOH NH4NO3难度: 中等查看答案及解析
-
下列物质中,属于有机合成材料的是( )
A.棉花
B.塑料
C.陶瓷
D.蚕丝难度: 中等查看答案及解析
-
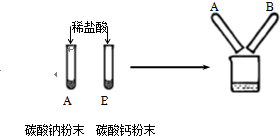
某兴趣小组设计实验探究碳酸钠、碳酸氢钠与盐酸反应过程中的放、吸热情况.操作步骤为:①向试剂1中加入试剂2,搅拌、测温;②静置、测温;③再加入试剂3,搅拌、测温、记录.得到了如下数据:
则下列说法中,错误的是( )试剂1 试剂2 温度/℃ 溶解后
温度/℃静置后
温度/℃试剂3 温度/℃ 混合后
温度/℃0.5gNa2CO3 10mL H2O 20.0 23.3 20.0 10mL HCl(20%) 20.0 23.7 0.5gNaHCO3 10mL H2O 20.0 18.5 20.0 10mL HCl(20%) 20.0 20.8
A.Na2CO3在溶于水的过程中放出热量
B.NaHCO3在溶于水的过程中吸收热量
C.其它条件相同时,碳酸氢钠溶液与盐酸混合过程中放出的热量更多
D.实验中,若同一列试剂的温度及所取的量不同,则实验结论的可信度降低难度: 中等查看答案及解析
-
下列做法有利于保护环境的是( )
A.开发洁净能源
B.丢弃废旧电池
C.大量使用化肥
D.焚烧废弃塑料难度: 中等查看答案及解析
-
以下应用守恒思想解决相关问题,推论正确的是( )
A.14 g碳与32g氧气反应,根据质量守恒推出生成的二氧化碳的质量为46g
B.聚乙烯燃烧生成二氧化碳和水,根据元素守恒推出聚乙烯由碳、氢、氧元素组成
C.50 mL36%的盐酸用50 mL水稀释,根据溶质守恒推出稀盐酸的溶质质量分数为l8%
D.水电解生成H2和02的分子数比为2:l,根据原子守恒推出水分子中H、0原子数比为2:1难度: 中等查看答案及解析
-
下列各组叙述中,有错误的是( )
A.钙、铁、锌都是人体必需的微量元素;维生素是给人体提供能量的主要物质
B.使用食品添加剂必须严格遵守国家有关规定;发现煤气泄漏应立即关闭阀门,开窗通风
C.用肥皂水可鉴别硬水和软水;氦气可用作填充探空气球
D.氢能源的大量应用需解决制取成本高、贮存困难等问题;CO2能造成温室效应,是一种有害的气体难度: 中等查看答案及解析
-
现有镁、铝两种金属分别跟稀盐酸充分反应,生成相同质量的氢气.则可能的情况有( )
A.足量的稀盐酸与等质量的镁、铝发生反应
B.足量的稀盐酸与质量比为4:3的镁、铝发生反应
C.足量的稀盐酸与质量比为8:9的镁、铝发生反应
D.等质量、等溶质质量分数的稀盐酸与过量的镁、铝发生反应难度: 中等查看答案及解析
-
将CO2通入滴有酚酞的BaCl2、NaOH混合溶液中,出现白色沉淀.下列说法错误的是( )
A.溶液的颜色肯定无明显变化
B.产生白色沉淀的化学方程式为:BaCl2+CO2+H2O=BaCO3↓+2HCl
C.反应后的溶液中一定有NaCl
D.反应过程中,溶液里BaCl2、NaOH的质量分数均减小难度: 中等查看答案及解析
-
除去下列物质中的少量杂质(括号里为杂质),所选用试剂及操作方法均正确的是( )
A.CO2(CO) 过量O2点燃
B.CuO(Cu) 适量稀盐酸 溶解、过滤、洗涤、干燥
C.NaCl溶液(CaCl2) 适量Na2CO3溶液 过滤
D.稀硝酸(H2SO4) 适量BaCl2溶液 过滤难度: 中等查看答案及解析
-
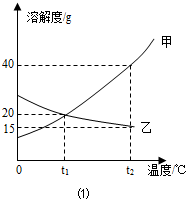
向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液.反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示.下列说法正确的是( )

A.图中Oa段表示生成沉淀的过程
B.b点溶液中溶质有2种
C.c点溶液的pH>7
D.x值为106.0难度: 中等查看答案及解析
-
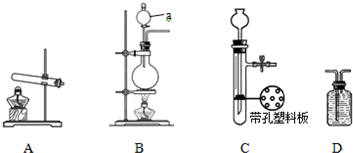
某化学小组在课外活动时做了一个实验,在甲试管中装入固体物质,乙试管中装入试剂溶液,按如图所示组装好仪器(图中铁架台等仪器已略去).通过分液漏斗加入足量稀硫酸,同时打开止水夹,看到乙试管液体中有气泡冒出;再关闭止水夹,发现一段时间后乙中溶液变浑浊.符合此实验现象的一组试剂是( )
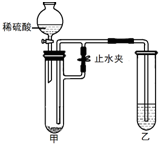
A.KNO3 BaCl2
B.Na2CO3 NaOH
C.Zn Ba(OH)2
D.MgCO3 Ba(NO3)2难度: 中等查看答案及解析
-
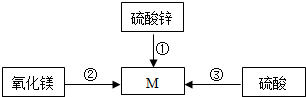
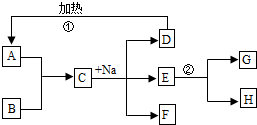
初中化学中几种常见物质之间的相互转化关系如图所示.已知常温下B、C为气体,且B是植物进行光合作用的一种重要原料;D、F均为无色液体,都由两种相同的元素组成,且分子中原子个数比依次为2:1和1:1;E为黑色固体,与稀硫酸反应得到蓝色溶液(部分反应物和生成物及反应条件已略去).下列有关判断正确的是( )
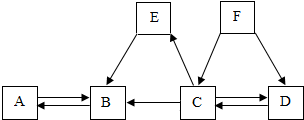
A.E转变为B一定是置换反应
B.A不一定是含CO32-或HCO3-的盐
C.D、F中相同元素的化合价一定相同
D.除去B中混有的少量C,可以将混合气体通过盛有NaOH溶液的洗气瓶难度: 中等查看答案及解析