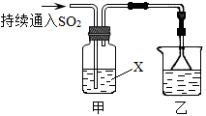-
十七大报告指出,应加强能源资源节约和生态环境保护,增强可持续发展能力。下列行为与之不相符的是
A.大量使用化学肥料,提高农作物的产量和质量
B.将作物秸秆通过化学反应转化为乙醇用作汽车燃料
C.使用资源节约型、环境友好型的生物降解塑料包装
D.推广煤炭脱硫技术、减少直接燃煤,防止酸雨发生
难度: 简单查看答案及解析
-
在自然界中既能以游离态存在又能以化合态存在的元素是
A.钠 B.硫 C.氯 D.钙
难度: 简单查看答案及解析
-
下列说法正确的是
A.合成纤维和光导纤维都是新型无机非金属材料
B.4.0g NaOH固体中所含分子数为0.1NA(NA表示阿伏加德罗常数的值)
C.纯碱、烧碱、漂白粉都属于盐类
D.Cl2使湿的红色布条褪色是因为HClO有漂白性
难度: 简单查看答案及解析
-
不能用于判断金属失电子能力强弱的是
A.同主族金属元素原子半径大小
B.1 mol金属单质在反应中失去电子的多少
C.水溶液中金属间发生的置换反应
D.金属元素最高价氧化物对应水化物的碱性强弱
难度: 简单查看答案及解析
-
有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列有关硅的说法中,不正确的是
A.高纯度的硅广泛用于制作计算机
B.硅可由二氧化硅还原制得
C.低温时,硅与水、空气和酸不反应,但能与氢氟酸反应
D.自然界中硅的储量丰富,自然界中存在大量的单质硅
难度: 简单查看答案及解析
-
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3纳米)恢复了磁性,“钴酞菁”分子结构和性质与人体的血红素及植物体内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是
A.均匀分散在水中所形成的分散系属悬浊液
B.分子直径比Na+小
C.均匀分散在水中形成的分散系能产生丁达尔效应
D.“钴酞菁”分子不能透过滤纸
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.标准状况下,22.4L H2O含有NA个分子
B.1L 1mol·L -1的NaClO 溶液中含有ClO-的数目少于NA个
C.0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子
D.0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA
难度: 中等查看答案及解析
-
X、Y、Z、w四种物质的转化关系如图所示(部分反应物和产物已经省略)。
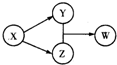
下列组合中不符合该关系的是
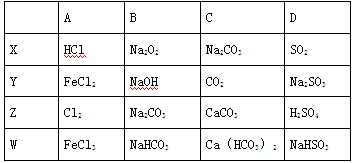
难度: 简单查看答案及解析
-
下列分子或离子在指定条件的分散系中能大量共存的是
A.Ca(NO3) 2溶液中: Fe2+、H+、Cl—、SO42—;
B.使pH试纸变蓝的溶液中:K+、NH4+、S-、SO32-;
C.水电离出的c(H+)=10-12 mol·L-1的溶液中:Na+、Ba2+、HCO3—、CH3COO-[;
D.透明的强酸性溶液中: Al3+、Fe3+、Cl-、SO42
难度: 中等查看答案及解析
-
下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
难度: 简单查看答案及解析
-
工业废气中的氮氧化物(如NO、NO2等,用通式NOx表示)是主要的大气污染物之一.为了保护环境,工业上常通入氨气与之发生如下反应:NOx+NH3―→N2+H2O来消除污染.有关此反应,下列说法中错误的是
A.N2既是氧化产物又是还原产物
B.当x=1时,每生成2.5 mol N2,被氧化的气体有3 mol
C.当x=2时,有1 mol气体被还原,转移电子4 mol
D.反应通式配平表示为:6NOx+4xNH3===(3+2x)N2+6xH2O
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.电解饱和NaCl溶液:2Cl-+2H+
H2↑+Cl2↑
B.向Na2SO3溶液中滴加足量NaClO溶液:
+ ClO-=
+ Cl-
C.向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl-
D.向Ca(OH)2溶液中加少量NaHCO3溶液:
难度: 简单查看答案及解析
-
将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
难度: 简单查看答案及解析
-
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大。下列说法正确的是
A.M与X形成的化合物对应的水化物一定是强酸
B.Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同
C.X、Y的简单离子半径:r(X2-)>r(Y+)
D.M的气态氢化物比N的气态氢化物稳定
难度: 中等查看答案及解析
-
中学化学教材中,常借助于图像的这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是
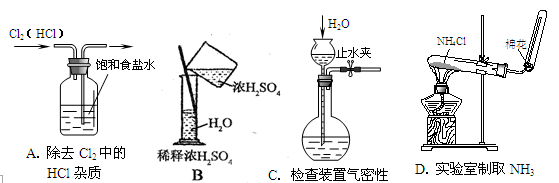
难度: 中等查看答案及解析
-
将a g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08 mol,放出标准状况下气体0.224 L.则下列判断中正确的是
A.原混合物中n(Fe)∶n(Fe2O3)=2∶1
B.向溶液中滴入KSCN溶液,显红色
C.无法计算原混合物的质量a
D.此时溶液中Fe2+和Fe3+的物质的量之比为3∶1
难度: 中等查看答案及解析