-
化学与人类生活、生产密切相关,下列说法正确的是
A. 在月饼包装袋中放入生石灰可防止食品氧化变质
B. 航天飞船使用的碳纤维是一种新型有机合成材料
C. 加入Na2S可除去工业废水中Cu2+和Hg2+等离子
D. 天然纤维和合成纤维的主要成分都属于纤维素
难度: 中等查看答案及解析
-
我国宋代著作《天工开物》中记载:“百里内外,土中必生可燔石。……火力到后,烧酥石性,置于风中久自吹化成粉。急用者以水沃之,亦自解散”。文中没有涉及到的物质是
A. 石灰石 B. 生石灰 C. 熟石灰 D. 熟石膏
难度: 中等查看答案及解析
-
某有机物的结构简式如图所示,下列对该有机物的说法正确的是
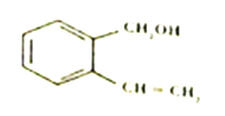
A. 分子中所有原子不可能在同一平面内
B. 含有苯环和醛基的同分异构体有13种
C. 该有机物能被灼热的CuO 氧化为羧酸
D. 该有机物能发生加成、取代、消去等反应
难度: 中等查看答案及解析
-
用下列有关实验装置进行下列实验,选用仪器和操作都正确的是
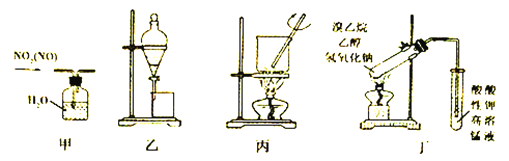
A. 用甲装置除去NO2 中的NO B. 用乙装置分离乙酸乙酯和饱和碳酸钠溶液
C. 用丙装置将海带灼烧成灰 D. 用丁装置验证溴乙烷发生消去反应
难度: 困难查看答案及解析
-
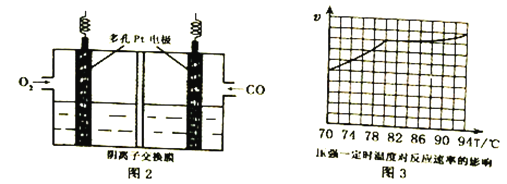
微生物燃料电池( MPC)处理技术是通过微生物的作用去除污染物,该技术可广泛应用于去除土壤中有机污染物。一种土壤微生物燃料电池的纵截面如图所示,下列说法不正确的是
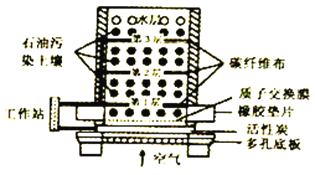
A. 电流从活性炭电极经工作站流向碳纤维布电极
B. 有机污染物在电池负极上氧化为对环境无害的物质
C. 活性炭能有效吸附空气,提高电池的工作效率
D. 该电池的正极反应式为O2+4e -↓+2H2O==4OH-
难度: 困难查看答案及解析
-
现有三种短周期元素组成的单质a、b、c 及其二元化合物X、Y、Z,它们之间相互转化关系如图所示。已知:X 中a和b元素的原子个数比为1:1;常温下L是一种无色黏稠油状液体。下列说法不正确的是

A. b、c 单质中所含的元素属于同主族元素 B. X、Y、Z 分子中一定都含有极性共价键
C. L、Y、Z 三种物质中两两之间能相互反应 D. 同温同浓度的水溶液中酸性强弱为:L>Y>Z
难度: 困难查看答案及解析
-
常温下,醋酸和氨水的电离常数均为1.8×10-5。现取浓度均为0.1mol/L 的醋酸溶液与氨水各20mL,分别用0.1mol/L的NaOH 溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH 滴加溶液的体积变化关系如图所示。下列说法正确的是
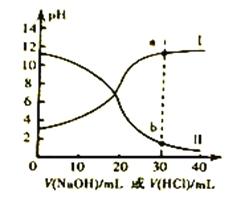
A. 曲线I中,滴加溶液到10mL时:2c(H+)+c(CH3COOH) =c(CH3COO-)+2c(OH-)
B. 曲线II中,滴加溶液到20mL时: c(NH4+) >c(Cl-)>c(OH -)>c(H+)
C. 曲线II中,滴加溶液时始终存在: c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D. 若将a 和b 两点对应的溶液混合,所得溶液常温下pH<7
难度: 困难查看答案及解析


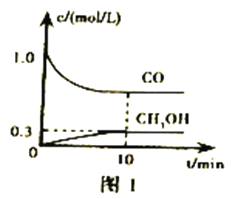



 ;
; 合成聚1.3- 丁二烯的路线流程图( 无机试剂任选)。 ______________________________
合成聚1.3- 丁二烯的路线流程图( 无机试剂任选)。 ______________________________