-
(2014•长宁区一模)①②③④甲种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
难度: 中等查看答案及解析
-
已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式不正确的是( )
A. 原子半径:X>Y B. 原子序数:X>Y
C. 离子半径:Y>X D. a=b+m-n
难度: 简单查看答案及解析
-
0.05 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是
A.第三周期第IA族 B.第四周期第IA族
C.第三周期第ⅡA族 D.第四周期第ⅡA族
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 纯净物中一定存在化学键
B. 阴、阳离子间通过静电引力而形成的化学键叫做离子键
C. 离子化合物中可能含共价键,共价化合物中不含离子键
D. 只有金属元素和非金属元素化合时才能形成离子键
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.MgCl2的形成过程可表示为
B.H2O分子的结构式可表示为H—O—H
C.NaOH是离子化合物,所以不含共价键
D.Na2S的电子式为
难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A. 反应热指的是反应过程中放出的热量 B. 伴随着能量变化的过程不一定是化学反应
C. 中和反应都是放热反应 D. 单液原电池中化学能转化成电能和热能
难度: 简单查看答案及解析
-
已知298 K时,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,推测含1 mol HCl的稀溶液与含1 mol NH3的稀溶液反应放出的热量 ( )
A. 大于57.3 kJ B. 等于57.3 kJ
C. 小于57.3 kJ D. 无法确定
难度: 中等查看答案及解析
-
下列过程中ΔH小于零的是( )
A.Ba(OH)2与NH4Cl固体混合 B.氯化铵分解得氨气
C.碳酸钙分解得二氧化碳 D.实验室制备氢气
难度: 简单查看答案及解析
-
白磷会对人体造成严重的烧伤,白磷(P4)分子结构为
。下列说法不正确的是
A.白磷着火点低,在空气中可自燃
B.白磷、红磷互为同素异形体
C.31 g白磷中,含P—P键1.5 mol
D.已知P4(白磷,s)+3O2(g)===2P2O3(s) ΔH=-Q kJ·mol-1,则白磷的燃烧热为Q kJ·mol-1
难度: 中等查看答案及解析
-
已知H—H键的键能为436 kJ/mol,O=O键的键能为498 kJ/mol,根据热化学方程式H2(g)+
O2(g) =H2O( l ) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )
A. 485.5 kJ/mol B. 610 kJ/mol C. 917 kJ/mol D. 1220 kJ/mol
难度: 中等查看答案及解析
-
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
难度: 中等查看答案及解析
-
已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽,测得放出热量a kJ。又知12.0 g碳完全燃烧,放出热量为 b kJ。则热化学方程式C(s)+1/2O2(g)===CO(g) ΔH=Q,其中Q等于( )
A. -(a-b) kJ·mol-1 B. -(a+b) kJ·mol-1
C. -(5a-0.5b) kJ·mol-1 D. -(10a-b) kJ·mol-1
难度: 简单查看答案及解析
-
下列关于原电池的叙述中,不正确的是( )
A. 原电池的负极发生的反应是氧化反应 B. 原电池的电极只能由两种不同的金属构成
C. 原电池能将化学能转变为电能 D. 原电池中电子流入的一极是正极
难度: 中等查看答案及解析
-
有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )
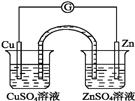
A. 铜片上发生氧化反应 B. 取出盐桥后,电流计依然发生偏转
C. 反应中,盐桥中的K+会移向CuSO4溶液 D. 反应前后铜片质量不改变
难度: 中等查看答案及解析
-
锌锰干电池在放电时电池总反应方程式为Zn+2MnO2+2NH
===Zn2++Mn2O3+2NH3↑+H2O。在此电池放电时,正极(碳棒)上发生反应的物质是( )
A. 锌 B. MnO2和NH
C. 碳 D. Zn2+和NH3
难度: 中等查看答案及解析
-
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电,电池负极反应为( )
A. H2+2OH-=2H2O+2e-
B. O2+4H++4e-=2H2O
C. H2-2e-=2H+
D. O2+2H2O+4e-=4OH-
难度: 中等查看答案及解析