-
为了更好地利用资源,我们应该“珍惜地球资源,转变发展方式”。下列行为不符合该主题的是
A.开发太阳能、氢能、风能等新能源
B.应用高效洁净的能源转化技术
C.更新采煤、采油技术,提高产量以满足工业生产的快速发展
D.减少资源消耗,增加资源的重复使用、资源的循环再生
难度: 简单查看答案及解析
-
分析如图的能量变化示意图,确定下列选项中正确的是
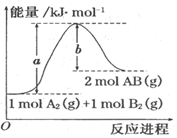
A.A2(g)+B2(g)=2AB(g) △H﹤0
B.每生成2分子AB放出bkJ热量
C.该反应中反应物的总能量低于生成物的总能量
D.断裂1molA-A键吸收akJ能量
难度: 简单查看答案及解析
-
一定条件下,反应N2(g)+3H2(g)
2NH3(g)在10L的密闭容器中进行,测得2min内N2的物质的量由20mol减小到8mol,则2min内用NH3表示的反应速率为
A.1.2mol/(L·min) B.6.0mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
难度: 简单查看答案及解析
-
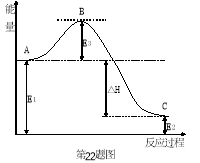
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸液体的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O △H﹥0
难度: 简单查看答案及解析
-
已知热化学方程式:2A(g)+B(g)
2C(g) ΔH=-QkJ·mol-1(Q﹥0)。下列说法正确的是
A.相同条件下,2molA(g)和1molB(g)所具有的总能量小于2mol C(g)所具有的能量
B.增大压强或升高温度,该平衡都向逆反应方向移动
C.将2molA(g)和1molB(g)置于一密闭容器中充分反应后,放出热量为QkJ
D.如将一定量A(g)和B(g)置于某密闭容器中充分反应放热Q kJ,则此过程中有2molA(g)被消耗
难度: 简单查看答案及解析
-
已知反应:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H=+74.9kJ.mol-1,下列说法中正确的是
A.该反应中熵变、焓变皆大于0
B.该反应是吸热反应,因此一定不能自发进行
C.在碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐的分解一定能自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
难度: 中等查看答案及解析
-
下表中是各组反应的反应物和反应温度,反应刚开始时放出H2速率最快的是
编号
金属(粉末状)
酸的浓度及体积
反应温度
A
Mg,0.1 mol
6mol·L-1 硝酸10mL
60℃
B
Mg,0.1 mol
3mol·L-1 盐酸10mL
60℃
C
Fe,0.1 mol
3mol·L-1L盐酸10mL
60℃
D
Mg,0.1 mol
3mol·L-1 硫酸10mL
60℃
难度: 简单查看答案及解析
-
下列对“改变反应条件,导致化学反应速率改变”的原因描述不正确的是
A.增大反应物的浓度,活化分子百分数增加,反应速率加快
B.增大气体反应的压强,单位体积中活化分子数增多,气体反应速率加快
C.升高温度能使化学反应速率增大,主要原因是增加了活化分子的百分数,从而使有效碰撞频率提高
D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大
难度: 中等查看答案及解析
-
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol下列结论正确的是
A.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
B.①的反应热为221kJ/mol
C.通过浓硫酸与稀NaOH溶液反应测得的中和热为57.3kJ/mol
D.碳的燃烧热的数值大于110.5kJ/mol
难度: 简单查看答案及解析
-
下列变化不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.合成氨工业中使用催化剂,以提高NH3的产量
C.红棕色的NO2加压后颜色先变深再变浅
D.CO2(g)
CO2(aq)ΔH<0,降温增压可增大二氧化碳气体在水中的溶解度
难度: 中等查看答案及解析
-
对于反应2A(g)+B(g)
3C(g)+4D(g),下列数据是用不同物质的浓度变化表示的反应速率,其中反应进行得最快的是
A.v(A)=30mol·L-1·min-1 B.v(B)=0.3mol·L-1·s-1
C.v(C)=48mol·L-1·min-1 D.v(D)=1mol·L-1·s-1
难度: 中等查看答案及解析
-
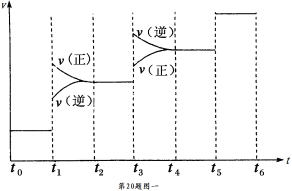
用来表示可逆反应:2A(g)+B(g)
3C(g)(正反应放热)的正确图像是

难度: 困难查看答案及解析
-
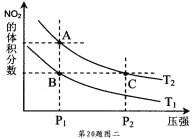
在一定条件下NO2与SO2气体发生反应:NO2(g)+SO2(g)
SO3(g)+NO(g) ΔH=-41.8kJ·mol-1
将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明该反应达到平衡状态的是
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO3的同时生成1molNO2
难度: 中等查看答案及解析
-
通常人们把拆开1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看成该化学键的键能。已知热化学方程式:N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ/mol,请根据热化学方程式和表中数据计算N≡N键的键能x约为
化学键
H-H
N≡N
H-N
键能
436 kJ/mol
x
391kJ/mol
A.431kJ/mol B.946kJ/mol C.649kJ/mol D.869kJ/mol
难度: 困难查看答案及解析
-
下列说法或表示方法正确的是
A.相同条件下,2mol氢原子所具有的能量大于1mol氢分子所具有的能量
B.已知C(s)+O2(g)=CO2(g) △H1;C(s)+1/2O2(g)=CO(g) △H2,则△H1﹥△H2
C.由C(s,石墨)=C(s,金刚石) △H=+73kJ/mol,可知金刚石比石墨稳定
D.据能量守恒定律,反应物的总能量一定等于生成物的总能量
难度: 中等查看答案及解析
-
已知反应:①H2(g)+
O2(g)=H2O(g) ΔH1
②
N2(g)+O2(g)=NO2(g) ΔH2
③
N2(g)+
H2(g)=NH3(g) ΔH3
则反应2NH3(g)+
O2(g)=2NO2(g)+3H2O(g)的ΔH为
A.2ΔH1+2ΔH2-2ΔH3 B.ΔH1+ΔH2-ΔH3
C.3ΔH1+2ΔH2+2ΔH3 D.3ΔH1+2ΔH2-2ΔH3
难度: 困难查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
zC(g)。平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低0.30mol/L。下列有关判断正确的是
A.x+y﹤z B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数升高
难度: 困难查看答案及解析
-
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)
2S03(g)并达到平衡。在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为a%,乙容器中SO2的转化率为b%,则a与b的关系为
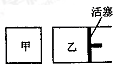
A.a﹥b B.a=b C.a﹤b D.无法确定
难度: 困难查看答案及解析