-
下列有关物质的性质与应用相对应的是
A.二氧化锰具有强氧化性,可用作H2O2分解的氧化剂
B.浓硝酸在常温下能使铝钝化,可用铝槽车运输浓硝酸
C.K2FeO4具有还原性,可用于自来水的杀菌消毒
D.SO2具有漂白性,能使紫色KMnO4溶液褪色
难度: 中等查看答案及解析
-
下列说法中,正确的是
A.含金属元素的离子不一定是阳离子
B.金属与盐溶液反应都是置换反应
C.玻璃是氧化物,成分可表示成Na2O.CaO.6SiO2
D.与强酸、强碱都反应的物质只有两性氧化物和两性氢氧化物
难度: 中等查看答案及解析
-
NA表示阿伏伽德罗常数,下列说法正确的是
A.常温下22.4LCO2分子数少于NA B.1molNaHCO3固体中含有NA个CO32-
C.NA个NO与NA个O2混合分子数为2NA D.1molCu反应转移电子数一定是2NA
难度: 中等查看答案及解析
-
正丁醛经催化加氢可制备1-丁醇。为提纯含少量正丁醛的1-丁醇,现设计如下路线:

已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;
②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;
③1-丁醇的沸点是118℃。则操作1~4分别是
A.萃取、过滤、蒸馏、蒸馏 B.过滤、分液、蒸馏、萃取
C.过滤、蒸馏、过滤、蒸馏 D.过滤、分液、过滤、蒸馏
难度: 中等查看答案及解析
-
下列各项操作中,不发生先沉淀后溶解现象的是
①向饱和Na2CO3溶液中通入过量的CO2
②向Na2SiO3溶液中逐滴加入过量稀硫酸
③向Ba(NO3)2溶液中通入过量的SO2
④向石灰水中通入过量的CO2气体
⑤向AlCl3溶液中逐滴滴加NaOH溶液至过量
A.①②③④ B.①②⑤ C.①②③⑤ D.①②③
难度: 中等查看答案及解析
-
(双选)在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓
B.NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+ Fe(OH)3↓+NH3•H2O
C.2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓
D.3NH4++Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+ Fe(OH)3↓+3NH3•H2O
难度: 中等查看答案及解析
-
下列说法中不正确的是
A.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存
B.在甲、乙两烧杯的溶液中,共含有Cu2+、K+、H+、Cl-、CO32-、OH-六种离子,已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是K+、OH-、CO32-
C.在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-浓度变化最小
D.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+不能大量共存
难度: 困难查看答案及解析
-
取a g某铁的氧化物R溶于足量稀盐酸,加水稀释至200mL,取20mL溶液,向其中滴加新制氯水,将其中的铁元素全部氧化为Fe3+,再向溶液中加NaOH溶液使其完全沉淀,所得沉淀经过滤、洗涤,灼烧至恒重,称量得b g固体,则下列判断正确的是
A.若a:b=9:1,则R的化学式为FeO
B.若a:b=29:30,则R的化学式为Fe3O4
C.若a:b=1:10,则R的化学式为Fe2O3
D.实验过程中被还原的Cl2为(10b-a)/8mol
难度: 中等查看答案及解析
-
(双选)一定条件下,将0.1LCO、0.2LCO2、0.1LNO、0.2LNO2和0.2LNH3混合,然后分别通过盛有足量蒸馏水、饱和NaHCO3溶液和NaOH溶液的三个洗气瓶(洗气瓶排列顺序不确定)。
假设气体通过每个洗气瓶都能充分反应则尾气(已干燥)
A.可能是单一气体 B.不可能含有CO
C.可能存在原气体中的两种气体 D.成分和洗气瓶的排列顺序无关
难度: 中等查看答案及解析
-
把一块镁铝合金投入到1mol/L 盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示。下列说法中不正确的是
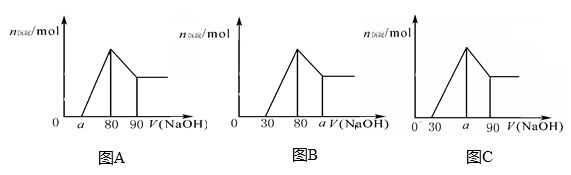
A.a的取值范围为0≤ a<50
B.
的最大值为2.5
C.若将关系图改为B图时,则
的取值范围为80<a<90
D.若将关系图改为C图时,则
的取值范围为75<a<90
难度: 中等查看答案及解析
-
工业上以CuFeS2为原料冶炼铜的主要反应为①2CuFeS2+4O2==Cu2S+3SO2+2FeO(炉渣);②2Cu2S+3O2=2Cu2O+2SO2;③2Cu2O+Cu2S=6Cu+SO2↑,下列说法错误的是
A.由1molCuFeS2生成1molCu,共消耗2.75molO2
B.该冶炼方法中产生大量的有害气体SO2,可回收用于制备硫酸
C.在反应③中,Cu2S既是氧化剂,又是还原剂
D.在反应①中,SO2既是氧化产物,又是还原产物
难度: 中等查看答案及解析
-
在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被水所还原的BrF3的物质的量是
A.1/3mol B.4/3mol C.1mol D.2mol
难度: 中等查看答案及解析
-
电视剧中所需的大量白烟是用NH4NO3和Zn粉按质量16:13混合放于温热的石棉网上,使用时滴数滴水产生的,又知发生反应后有N2和水生成。有关的说法中正确的是
①水起着溶解NH4NO3、发生吸热现象以及启动反应发生的作用;
②1molNO3-在反应中得5mole-;
③成烟物质是氧化锌小颗粒;
④NH4+是氧化剂
A.①② B.②③ C.③④ D.①④
难度: 中等查看答案及解析
-
现有一定量的铁粉和铜粉的混合物,将其平均分成四份,分别加入同浓度不同体积的稀硝酸,充分反应后,在标准状况下生成NO的体积和剩余金属的质量如表所示(假设硝酸的还原产物只有NO一种)。根据上表中的数据计算分析,下列推断正确的是
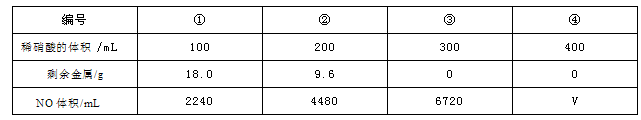
A.①中溶解了5.6gFe B.②中溶解了9.6gCu
C.硝酸的物质的量浓度为4 mol•L-1 D.④中V=6720
难度: 困难查看答案及解析
-
将19gKOH和KHCO3的混合物,在260℃时煅烧充分反应,冷却后称量,固体质量减少0.98g。则混合物中KOH和KHCO3的物质的量关系正确的是
A.n(KOH) = n(KHCO3) B.n(KOH) < n(KHCO3)
C.n(KOH) > n(KHCO3) D.KOH、KHCO3任意比
难度: 中等查看答案及解析