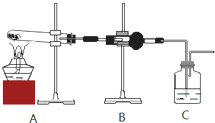
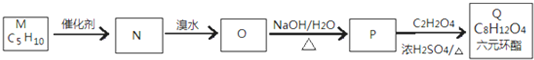
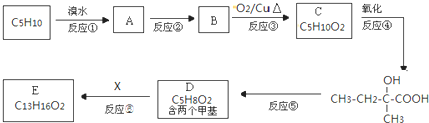
-
水热反应是指在高温高压下,将二氧化碳转化为有机物的技术,不仅能实现二氧化碳到有机物的转化,还可以将废水中的有机物转化成煤炭等资源.下列有关水热反应的说法中,不正确的是( )
A.一定包含化学变化
B.可以降低自然界中碳的含量
C.可以改善温室效应
D.可以重建地球上碳资源的和谐循环难度: 中等查看答案及解析
-
已知Cl2、Al2(SO4)3、C2H5Br、CH3COOCH3等物质均能与水发生反应,反应时各物质和水均分别离解成两部分,然后再两两重新组合,形成新的物质.下列化学方程式中正确的是( )
①ICl+H2O═HIO+HCl ②CH3COCl+H2O→CH3COOH+HCl
③SiCl4+4H2O═H4SiO4+4HCl ④Mg3N2+6H2O═3Mg(OH)2+2NH3↑
A.①④
B.②③
C.①③④
D.①②③④难度: 中等查看答案及解析
-
下列实验对应的结论正确的是( )
A.
实验室制取乙炔
B.
能证明非金属性Cl>C>Si
C.
分离出Cl2与KI溶液反应生成的碘
D.
白色沉淀是BaSO3难度: 中等查看答案及解析
-
下列有关说法中,不正确的是( )
A.在0.1mol/L的 Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大
B.常温下,CH3COONa溶液的pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol/L
C.常温下,0.1mol/L的某酸溶液中,若c(OH-)/c(H+)=1×10-8,则溶液中由水电离出的c(H+)=1×10-11mol/L
D.a mol/L的 HCN溶液与b mol/L 的NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b难度: 中等查看答案及解析
-
萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( )
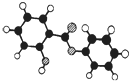
A.萨罗的分子式为C13H10O3
B.1mol萨罗发生水解,需要消耗3mol NaOH
C.1mol萨罗与浓溴水反应,需要消耗3mol Br2
D.萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸)难度: 中等查看答案及解析
-
下列图示与对应叙述相符合的是
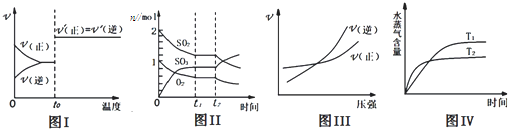 ( )
( )
A.图I:反应H2+I2⇌2HI 达平衡后,升高温度时反应速率随时间的变化
B.图Ⅱ:反应2SO2+O2⇌2SO3 达平衡后,缩小容器体积时各成分的物质的量变化
C.图III:反应N2+3H2⇌2NH3在温度一定的情况下,反应速率与压强的关系
D.图IV:反应CO2(g)+H2(g)⇌CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化难度: 中等查看答案及解析
-
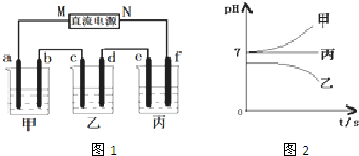
一种碳纳米管(氢气)二次电池原理如右图.该电池的电解质为6mol/L的KOH溶液,下列说法正确的是( )
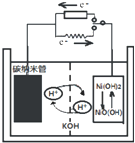
A.储存H2的碳纳米管放电时为负极,充电时为阳极
B.放电时正极附近溶液的pH减小
C.放电时负极反应为H2+2OH--2e-═2H2O
D.充电时阳极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH-难度: 中等查看答案及解析