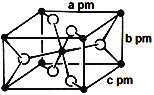
-
有关杂化轨道理论的说法不正确的是
A.杂化轨道全部参加形成化学键
B.杂化前后的轨道数不变,但轨道的形状发生了改变
C.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
D.四面体形、三角锥形的结构可以用sp3杂化轨道解释
难度: 中等查看答案及解析
-
下列化学用语的表述正确的是( )
A. 离子结构示意图
:可以表示16O2-,也可以表示18O2-
B. 比例模型
 :可以表示甲烷分子,也可以表示四氯化碳分子
:可以表示甲烷分子,也可以表示四氯化碳分子C. 氯化铵的电子式为
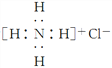
D. CO2的结构式为O—C—O
难度: 中等查看答案及解析
-
对于排布在2s轨道上的电子,不能确定的是
A. 电子所在的电子层 B. 电子的自旋方向
C. 电子云的形状 D. 电子云的伸展方向
难度: 中等查看答案及解析
-
下列各组微粒中,互为等电子体的是
A. H3O+和OH- B. SO42-和PO43- C. NO3-和NO2- D. CH3+和NH4+
难度: 中等查看答案及解析
-
下列各组晶体中,化学键种类相同,晶体类型也相同的是
A. SO2与SiO2 B. NaCl与HCl C. CO2与H2O D. CCl4与KCl
难度: 简单查看答案及解析
-
下列关于化合物A(结构简式如图)的叙述中正确的是
A. 分子中只有极性键
B. 该分子中三种元素的电负性:H>C>O
C. 分子中有σ键和兀键
D. 该分子在水中的溶解度小于甲烷的
难度: 中等查看答案及解析
-
下列晶体熔化时不需破坏化学键的是
A. 晶体硅 B. 食盐 C. 干冰 D. 二氧化硅
难度: 简单查看答案及解析
-
现有三种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p5 则下列有关比较中正确的是 ( )
A. 原子半径:①>②>③ B. 第一电离能:③>②>①
C. 电负性:③>②>① D. 最高正化合价:③>①>②
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 丙烯分子有7个σ键,1个π键
B. 由2H和18O所组成的水11g,其中所含的中子数为4NA
C. 0.1mol SiO2晶体中所含有的硅氧键数目为0.2NA
D. 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个
难度: 中等查看答案及解析
-
氰气的分子式为(CN)2,结构式为N≡C—C≡N,性质与卤素相似。下列叙述正确的是( )
A. 不能和氢氧化钠溶液发生反应 B. 分子中N≡C键的键长大于C—C键的键长
C. 该分子与H2O2分子的空间构型类似 D. 分子中原子的最外层均满足8电子结构
难度: 中等查看答案及解析
-
下列描述中不正确的是( )
A. CS2为Ⅴ形的极性分子 B. ClO3-的空间构型为三角锥形
C. SF6中有6对完全相同的成键电子对 D. SiF4和SO32-的中心原子均为sp3杂化
难度: 中等查看答案及解析
-
下列现象与氢键有关的是( )
①HF的熔、沸点比第ⅦA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的溶、沸点比醋酸的高
⑤邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的低
⑥水分子在较高温度下也很稳定
A.①②③④⑤⑥ B.仅①②③④⑤
C.仅①②③④ D.仅①②③
难度: 中等查看答案及解析
-
CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22﹣存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )
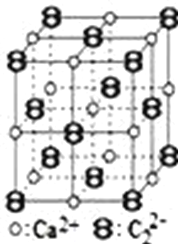
A. 1 个 Ca2+周围距离最近且等距离的 C22﹣数目为 6
B. 该晶体中的阴离子与F2是等电子体
C. 6.4 g CaC2晶体中含阴离子0.1 mol
D. 与每个Ca2+距离相等且最近的Ca2+共有12个
难度: 困难查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X 的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径: W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
难度: 中等查看答案及解析
-
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如右图所示。以下有关该物质的说法中正确的是( )

A. 每个N5+中含有35个质子和36个电子
B. 该离子中有非极性键和配位键
C. 该离子中含有2个π键
D. 与PCl4+互为等电子体
难度: 中等查看答案及解析
-
石墨烯是由碳原子构成的单层片状结构的新材料(结构如图所示),可由石墨剥离而成。石墨烯的硬度极大,甚至超过了金刚石。下列说法正确的是 ( )
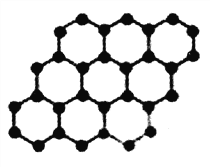
A. 石墨烯、石墨、金刚石、C60互为同位素
B. 石墨烯中碳原子个数与碳碳键数目之比为2:3
C. 石墨烯中碳原子采用sp3杂化
D. 石墨烯的熔点比C60低
难度: 中等查看答案及解析
-
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N
N放出942 kJ热量。根据以上信息和数据,判断下列说法正确的是( )
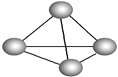
A. N4属于一种新型的化合物 B. N4分子中存在非极性键
C. N4和N2是同分异构体 D. 1 mol N4转变成N2将吸收882 kJ热量
难度: 中等查看答案及解析
-
下列关于晶体的说法一定正确的是( )
A. 分子晶体中都存在共价键
B. 右图CaTiO3晶体中每个Ti4+与12个O2-相紧邻
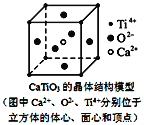
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 在二氧化硅晶体中,最小环上的原子个数是六
难度: 中等查看答案及解析
-
根据相似相溶规则和实际经验,下列叙述不正确的是 ( )
A. 白磷(P4)易溶于CS2,但难溶于水
B. NaCl易溶于水,难溶于CCl4
C. 碘易溶于苯,微溶于水
D. 卤化氢易溶于水,也易溶于CCl4
难度: 简单查看答案及解析
-
下列有关金属晶体的说法中,正确的是( )
A. 简单立方堆积的晶胞中原子配位数是8
B. 晶胞中配位数为12的金属,一定是面心立方最密堆积
C. Zn的晶胞类型与铜相同
D. 铁的晶胞中空间利用率为68%
难度: 中等查看答案及解析
-
根据陈述的知识,类推得出的结论正确的是( )
A. 钠在空气中燃烧生成的氧化物是Na2O2,则锂在空气中燃烧生成的氧化物是Li2O2
B. NH3和PCl3是等电子体,均为三角锥形结构
C. CO2和SiO2 化学式相似,则CO2与SiO2的物理性质也相似
D. 第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3
难度: 中等查看答案及解析
-
下面的排序不正确的是 ( )
A. 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 B. 硬度由大到小:金刚石>碳化硅>晶体硅
C. 熔点:Na<Mg<Al D. 酸性:HClO>HClO2>HClO 3>HClO4
难度: 中等查看答案及解析
-
下列各组物质性质的比较中正确的是( )
A. CH4、CCl4、C60都是含有极性键的非极性分子
B. 非金属氢化物的稳定性顺序:H2O>H2S>H2Se,HCl<H2S<PH3
C. 弱电解质水溶液导电能力不一定比强电解质水溶液导电能力弱
D. 空间利用率:简单立方堆积<体心立方堆积<六方最密堆积<面心立方最密堆积
难度: 中等查看答案及解析
-
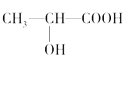
下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(
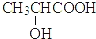 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子

难度: 中等查看答案及解析
-
下列说法正确的是
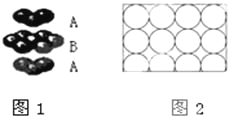
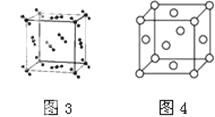
A. 钛和钾都采取图1的堆积方式
B. 图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积
C. 图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围最近且等距离的CO2有8个
D. 图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC…堆积的结果
难度: 中等查看答案及解析
 ]m,是常用的水处理剂。基态铁原子的核外电子排布式为___________,聚合硫酸铁中铁元素阳离子有_________个未成对电子。
]m,是常用的水处理剂。基态铁原子的核外电子排布式为___________,聚合硫酸铁中铁元素阳离子有_________个未成对电子。