-
过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。
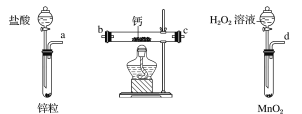
(1)请选择必要的装置,按气流方向连接顺序为_____________(填仪器接口的字母编号,装置可重复使用)。
(2)根据完整的实验装置进行实验,实验步骤如下:①检验装置的气密性后,装入药品;②打开分液漏斗活塞通入一段时间气体,加热药品;③反应结束后,_______________(填操作);④拆除装置,取出产物。
(3)一小组同学利用CaCl2在碱性条件下与H2O2反应制得。制备CaO2的实验方案和装置示意图如下:

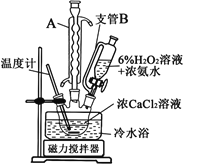
①三颈烧瓶中发生的主要反应的化学方程式为___________________________________;
②支管B的作用是_________________________;
③步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
④该反应常用冰水浴控制温度在0℃左右,其可能的原因该反应是放热反应,温度低有利于提高CaO2·8H2O产率;________________________________________。
(4)测定产品中CaO2含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴________(作指示剂)。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2 次,得出三次平均消耗Na2S2O3溶液的体积为V mL。
CaO2的质量分数为________(用字母表示)。(已知:I2 + 2S2O ===2I-+ S4O
===2I-+ S4O )
)
-
科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用FeO 吸收获得H2。
i. 6FeO(s) +CO2(g)=2Fe3O4(s) +C(s) △Hl =-76.0 kJ·mol-1
ⅱ. C(s) +2H2O(g)=CO2(g) +2H2(g) △H2 = +113.4 kJ·mol-1
(1)3FeO(s) +H2O(g)= Fe3O4(s) +H2(g) △H3 =_________。
(2)在反应i中,每放出38.0 kJ热量,有______g FeO被氧化。
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
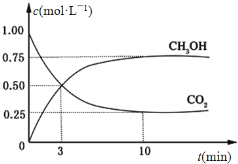
(3)从反应开始到平衡,氢气的平均反应速率v(H2)=___________________ mol·(L·min) -1。
(4)氢气的转化率=________________________。
(5)该反应的平衡常数为__________________________ (保留小数点后2位)。
(6)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
A.升高温度 B.充入He(g),使体系压强增大
C.再充入1 mol H2 D.将H2O(g)从体系中分离出去
(7)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________c2的关系(填“>”、“<”或“=”)。
III.CO2可用碱溶液吸收获得相应的原料。
利用100 mL 3 mol·L—1NaOH溶液吸收4.48 LCO2(标准状况),得到吸收液。
(8)该吸收液中离子浓度的大小排序为___________________。将该吸收液蒸干,灼烧至恒重,所得固体的成分是_________(填化学式)。
-
钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如下:
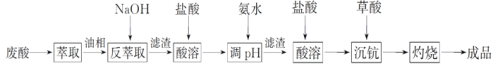
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是______________________________。
(2)先加入氨水调节pH=3,过滤,滤渣主要成分是__________;再向滤液加入氨水调节pH=6,滤液中Sc3+的浓度为_____________。(已知:Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中 =__________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式__________________________________。[已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5]
=__________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式__________________________________。[已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5]
(4)草酸钪“灼烧”氧化的化学方程式为______________________________________________。
(5)废酸中含钪量为15 mg·L-1,V L废酸最多可提取Sc2O3的质量为____________。
-
常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价层电子排布式为________;高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:______________________________________________。
(2)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是___________________________。
(3)GaCl3和AsF3的立体构型分别是____________,____________。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为______________。
②[B(OH)4]-的结构式为________________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
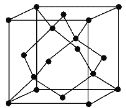
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是________________(用化学式表示);
②金刚石的晶胞参数为a pm(1 pm=10-12 m)。 1cm3晶体的平均质量为______________(只要求列算式,阿伏加德罗常数为NA)。
-
H是一种新型香料的主要成分之一,其合成路线如下(部分产物和部分反应条件略去):
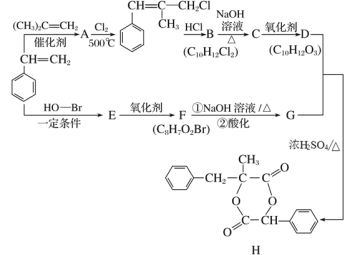
已知:①RCH=CH2+CH2==CHR′ CH2=CH2+RCH=CHR′;
CH2=CH2+RCH=CHR′;
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
请回答下列问题:
(1)(CH3)2C=CH2的同分异构体中存在顺反异构的有机物的名称为________。
(2)A的核磁共振氢谱除苯环上的H外,还显示________组峰,峰面积比为________。
(3)D分子中含有的含氧官能团名称是________,E的结构简式为__________________。
(4) 发生加聚反应的化学方程式为____________________________;D和G反应生成H的化学方程式为_________________________________________。
发生加聚反应的化学方程式为____________________________;D和G反应生成H的化学方程式为_________________________________________。
(5)G的同分异构体中,同时满足下列条件的有________种(不包括立体异构)。
①苯的二取代物 ②与FeCl3溶液发生显色反应 ③含“-COO-”结构
(6)参照上述合成路线,以丙烯为原料(无机试剂任选),设计制备2,3-丁二醇的合成路线_______。
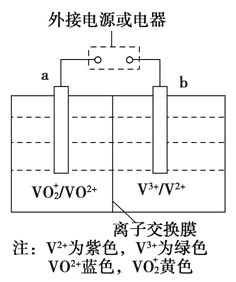
随温度升高而减小







