-
设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 标准状况下,11.2LH2和D2的混合气体中所含的质子数为NA
B. 1L0.5mol·L-1Na2CO3溶液中阴离子的总数为0.5NA
C. 28g乙烯和丙烯的混合物中所含碳碳双键的数目为NA
D. 向足量水中通入1mol氯气,反应中转移的电子数为NA
难度: 中等查看答案及解析
-
已知某离子反应为:8Fe2++NO3-+10H+=NH4++8Fe3++3H2O,下列说法不正确的是
A. Fe2+为还原剂,NO3-被还原
B. 消耗l mol氧化剂,转移电子8 mol
C. 氧化产物与还原产物的物质的量之比为1︰8
D. 若把该反应设计为原电池,则负极反应式为 Fe2+-e-=Fe3+
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 标准状况下,11.2LSO2气体中含氧原子数等于18g水中含有的氧原子数
B. 5.6 g铁与足量稀硫酸反应失去的电子的物质的最为0.3 mol
C. 100g98%的浓硫酸所含的氧原子个数为4mol
D. 20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol·L-1
难度: 中等查看答案及解析
-
标准状况下,将V LA气体(摩尔质量为M g/mol)溶于0.1 L水中,所得溶液密度为ρ g/mL,则此溶液物质的量浓度为( )
A.
mol/L B.
mol/L
C.
mol/L D.
mol/L
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 用润湿的pH试纸测定稀碱溶液的pH,测定值偏小
B. 用碱式滴定管量取22.00mL的KMnO4溶液
C. 用纯碱溶液清洗油污时,加热可以增强其去污能力
D. 用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂
难度: 中等查看答案及解析
-
化学实验的基本操作是完成化学实验的关键,下列实验操作正确的是( )
①用50 mL量筒量取5.2 mL稀硫酸
②用分液漏斗分离苯和四氯化碳的混合物
③用托盘天平称量117.7 g氯化钠晶体
④用量筒量取23.10 mL溴水
⑤用蒸发皿高温灼烧石灰石
⑥用250 mL容量瓶配制250 mL 0.2 mol·L-1的NaOH溶液;
A. ③⑥ B. ②③④⑤ C. ①②④ D. ②⑤⑥
难度: 中等查看答案及解析
-
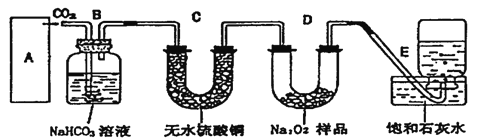
(题文)下列有关实验装置,能达到实验目的的是

A. 用图1所示装置制取少量Cl2 B. 用图2所示装置制取干燥的NH3
C. 用图3制备并检验H2的可燃性 D. 用图4装置鉴别碳酸钠和碳酸氢钠
难度: 简单查看答案及解析
-
下列实验操作或对实验事实的叙述正确的是( )
①用稀盐酸洗涤盛放过石灰水的试剂瓶
②配制浓硫酸和浓硝酸的混合酸时,将浓硝酸沿器壁慢慢加入到浓硫酸中,并不断搅拌;
③用pH试纸测得氯水的pH为2;
④用稀硝酸清洗做过银镜反应实验的试管;
⑤浓硝酸保存在棕色细口瓶中;
⑥将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡
⑦某溶液加入NaOH并加热能产生使湿润红色石蕊试纸变蓝的气体,则原溶液中含NH4+ .
A. ①④⑤⑦ B. ③④⑦ C. ①②⑥ D. ②③⑤⑥
难度: 中等查看答案及解析
-
已知S2O8n-离子和H2O2一样含过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子,若反应后S2O8n-离子生成SO42-离子;又知反应中氧化剂与还原剂的离子数之比为5:2则S2O8n-中的n值和S元素的化合价是( )
A. 2, +7 B. 2, +6 C. 4 ,+7 D. 4 , +4
难度: 简单查看答案及解析
-
下列有关实验操作、发生的现象、解释或结论都正确的是 ( )
选项
实验操作
发生的现象
解释或结论
A
向亚硫酸钠溶液中,逐滴加入硝酸酸化的硝酸钡溶液
产生白色沉淀
产生的亚硫酸钡是难溶解入水的沉淀
B
将SO2通入滴有酸性高锰酸钾溶液中
溶液紫红色褪去
SO2具有漂白性
C
常温下铜片插入硝酸中
产生红棕色气体
常温下铜和硝酸一定产生NO2
D
向某溶液中加入NaHCO3
产生白色沉淀
该溶液可能原来含有氢氧化钡
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
如图是某学校购买的硫酸试剂标签上的部分内容。据此下列说法正确的是

A. 该硫酸的物质的量浓度为1.84mol·L−1
B. 1mol Zn与足量的该硫酸反应产生2g H2
C. 配制200mL4.6mol·L−1的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol·L−1
难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是
A. 澄清透明的无色溶液中:Na+、K+、MnO4-、[Al(OH)4]-
B. 水电离出的[H+]=10-14mol/L溶液中:Fe2+、Mg2+、NO3-、Cl-
C. 加入铝能产生H2的溶液中:K+、NH4+、I-、NO3-
D. 常温下c(OH-)=10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、K+
难度: 困难查看答案及解析
-
下列有关实验原理、装置、操作的描述中正确的是
A
B
C
D
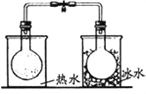
将NO2球浸泡在热水
和冷水中

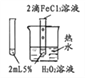

探究温度对平衡的影响
pH试纸的测定
研究催化剂对反应速率的影响
反应热的测定
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
利用太阳能分解制氢气,若光解0.02 mol水,下列说法正确的是( )
A. 可生成H2的质量为0.02g
B. 可生成氢的原子数为2.408×1023个
C. 生成H2的量理论上等于0.04mol Na与水反应产生H2的量
D. 可生成H2的体积为0.224L(标准情况)
难度: 简单查看答案及解析
-
某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质,下列说法不正确的是
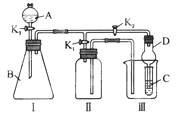
A.利用I、II装置制取气体(K2关闭、K1打开),可以收集H2等气体,但不能收集O2、NO气体
B.利用II装置作简单改进(但不改变瓶口朝向)后,可以收集O2、NO等气体,但不能收集NO2气体
C.利用I、Ⅲ装置可以比较H2SO4、H2CO3和H2SiO3的酸性强弱
D.利用I、Ⅲ装置既能验证氧化性:Ca(ClO)2>Cl2>Br2,又能保护环境
难度: 简单查看答案及解析
-
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有( )
①
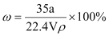
②
③上述溶液中加入V mL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A. ②③ B. ②④ C. ③④ D. ①③
难度: 中等查看答案及解析