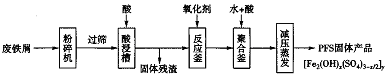
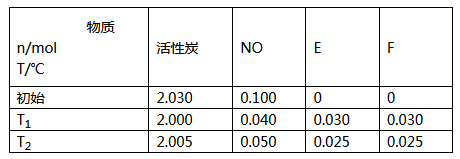
-
化学与生活密切相关,下列叙述中不正确的是
A. 糖类是人体能量的主要来源
B. 食盐可作调味剂,也可作食品防腐剂
C. 天然存在的动植物油脂,大多属于单甘油酯
D. 乙烯可作水果催熟剂,能促进水果尽早成熟
难度: 中等查看答案及解析
-
常温下,用0.10mol/LNaOH溶液滴定20.00 mL稀醋酸(HAc),下列说法中正确的是
A. 当混合溶液的pH>7时,其中不可能存在HAc分子
B. 当混合溶液的pH<7时,混合液中c(Na+)>c((Ac-)
C. 判断该滴定过程的终点,最好选择甲基橙作为指示剂
D. 达到滴定终点时,混合液中c(Na+)和c((Ac-)一定不相等
难度: 中等查看答案及解析
-
下列有关实验操作、现象、解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热
小木条不燃烧
Na2SiO3可作防火剂
B
将H2再充满Cl2的集气瓶中燃烧
集气瓶口上方有白烟生成
H2、Cl2化合生成HCl
C
将SO2通入酸性高锰酸钾溶液中
溶液褪色
SO2具有漂白性
D
出去表面氧化膜的铝箔,在酒精灯上充分加热
铝不能滴落下来
铝熔点高,没能熔化
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
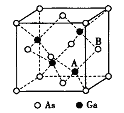
短周期元素X、Y、Z、W的原子序数依次增大.它们的原子最外层电子数之和为13 , X的原子半径比Y的小,其中X与W同主族。一种常见的无色无味液体分解可以得到X和Z元素的单质。下列说法中不正确的是
A. X、Y、Z三种元素可以形成离于化合物
B. 元素X 和W之间不可能形成二元化合物
C. 元素Y的简单气态氢化物的热稳定性比Z的弱
D. 元素Y、Z、W中,元素W的简单离子的半径最小
难度: 中等查看答案及解析
-
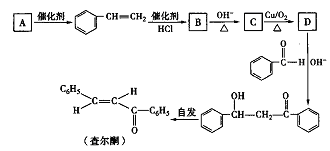
下列关于有机化合物的说法正确的是
A. C3H6和C4H8互为同系物
B. CH2Cl2有2种同分异构体
C. 苯乙烯分子中的所有原子不可能处于同一个平面
D. 乙酸与乙醉醇的酯化反应是可逆反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 1.8gNH4+中含有的电子数为1.1NA
B. 2.2gCO2和N2O的混合气体中原于数为0.15NA
C. 1molNa2O2与足量CO2反应,转移电子数为2NA
D. 25℃、101kPa时,2.24LCH4含有的共价键数为0.4NA
难度: 困难查看答案及解析
-
电解尿素[CO(NH2)2]的碱性溶掖可以制取氢气,其装置如下图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列有关说法中不正确的是
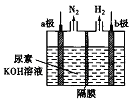
A. 电解过程中b极附近溶液碱性明显增强
B. 溶液中的OH-逐渐向a极区附近移动
C. 若在b极产生标准状况下224mL氢气,则消耗尿素2g
D. a极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
难度: 困难查看答案及解析