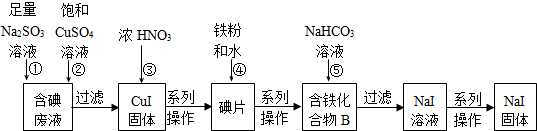
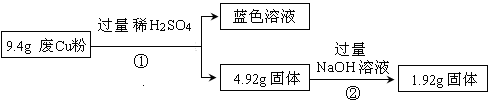
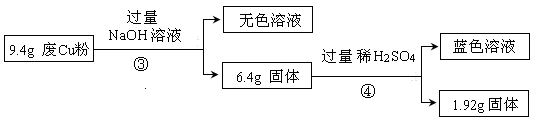
-
Al、Fe、Cu都是重要而常见的金属,下列有关说法正确的是
A.三者的单质在常温下都能溶于浓硫酸和浓硝酸
B.三者的单质放置在空气中均只生成氧化物
C.三者所对应的氢氧化物在水中都存在溶解平衡
D.工业上制备这三种金属的方法依次为电解法、热分解法和热还原法
难度: 中等查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子
B.1H与D互称同位素
C.H2O与D2O互称同素异形体
D.1H218O与D216O的相对分子质量相同
难度: 简单查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.CO2通人到CaCl2溶液中
B.NH3通人AlCl3溶液中
C.用脱脂棉包裹Na2O2粉末露置在潮湿空气中
D.稀盐酸滴加到Fe(OH)3胶体溶液中
难度: 简单查看答案及解析
-
下列推断正确的是
A.SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物
B.Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
难度: 简单查看答案及解析
-
实验室需要480mL1.0mol/L的NaOH溶液,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是
A.称取氢氧化钠20.0 g
B.定容时俯视观察刻度线
C.移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗
D.移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方
难度: 中等查看答案及解析
-
下列关于Cl、N、S等非金属元素单质及其化合物的说法正确的是
A.漂白粉的成分是次氯酸钙
B.实验室可用浓硫酸干燥硫化氢
C.将浓氨水滴到氢氧化钠固体中可以制取氨气
D.单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同
难度: 中等查看答案及解析
-
除去下列物质中含的杂质(括号内为杂质)。选用试剂正确的是
A.FeCl2溶液(FeCl3):Fe粉
B.CO2 (SO2):饱和的Na2CO3溶液
C.Al2O3 (SiO2):NaOH溶液
D.NaHCO3溶液(Na2CO3):Ca(OH)2溶液
难度: 中等查看答案及解析
-
向NaBr、NaI、Na2CO3的混合溶液中通入足量氯气后,将溶液蒸于并充分灼烧,得到固体剩余物的组成可能是
A.NaCl B.NaCl、NaHCO3
C.NaCl、I2 D.NaCl、NaI、Na2CO3
难度: 中等查看答案及解析
-
下列对于某些离子的检验及结论中一定正确的是
A.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+
难度: 中等查看答案及解析
-
某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子,若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是
A.NO3- B.CO32-、NO3- C.SO32-、NO3- D.CO32-、NO3-、Na+
难度: 中等查看答案及解析
-
科学家宣布发现了铝的“超级原子”结构——Al13和Al14。已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态.下列说法中,正确的是
A.Al13、Al14互为同位素
B.Al13超原子中Al原子间通过离子键结合
C.Al14最外层电子数之和为42,与第ⅡA族元素的性质相似
D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
难度: 中等查看答案及解析
-
PO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.Cu+2Fe3+═Cu2++2Fe2+
B.10Cl-+2MnO4-+16H+═2Mn2++5Cl2↑+8H2O
C.2Fe2++Cl2═2Fe3++2Cl-
D.5Pb2++2MnO4-+2H2O═5PbO2+2Mn2++4H+
难度: 中等查看答案及解析
-
Zn(OH)2是两性氢氧化物,和强酸反应时生成Zn2+,跟强碱反应时生成ZnO22-,现有三份等物质的量浓度、等体积的MgCl2、ZnCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液,分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如下图所示,则与MgCl2、ZnCl2、AlCl3三种溶液一一对应的正确图象是
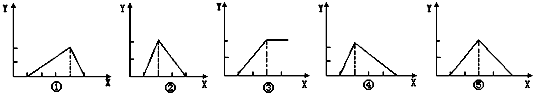
A.③②① B.③②④ C.③⑤① D.③⑤④
难度: 困难查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法正确的是
A.10 mL 20 mol•L-1浓硫酸与足量锌反应,转移电子数为0.2NA
B.0.1 mol24Mg18O晶体中所含中子总数为2.0 NA
C.在标准状况下,2.8g N2和2.24L CO所含电子数均为1.4NA
D.1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA
难度: 中等查看答案及解析
-
下列离子方程式不正确的是
A.Fe3O4与稀硝酸反应的离子方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3=2Cu2++CO2↑+3H2O
C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:
2Ba2++NH4++Al3++SO42-+4OH-=Al(OH)3↓+NH3•H2O+2BaSO4↓
D.少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
难度: 中等查看答案及解析
-
茶叶中铁元素的检验可经过以下四步骤完成,各步骤中选用的实验用品正确且完整的是
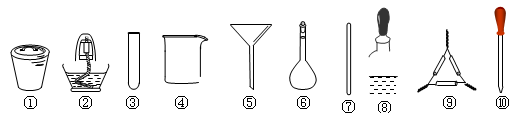
A.将茶叶灼烧灰化,选用①、②
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到的滤液,选用④、⑤
D.检验滤液中的Fe3+,选用③、⑧、⑩
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
A.Y的气态简单氢化物的热稳定性比W的强
B.X的最高价氧化物对应水化物的酸性比W的弱
C.Y分别与Z、W形成的化合物均为碱性氧化物
D.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
难度: 中等查看答案及解析
-
利用右图所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实验结论
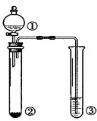
A
浓盐酸
MnO2
NaOH
制氯气并吸收尾气
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2溶液
SO2与可溶性钡盐均可生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
难度: 中等查看答案及解析
-
一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,Z是
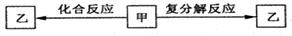
A.HCl B.FeCl2 C.KOH D.NaHCO3
难度: 简单查看答案及解析
-
0.6mol/L的Fe2(SO4)3和1.2mol/L的CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量为
A.0.16 mol B.0.22mol C.0.30mol D.0.48mol
难度: 中等查看答案及解析
-
下列离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全且正确的是
选项
离子组
加入试剂
发生反应的离子方程式
A
Fe3+、S2ˉ、Clˉ、Na+
NaOH溶液
Fe3++3OHˉ=Fe(OH)3↓
B
Na+、Al3+、Clˉ、SO42ˉ
少量KOH溶液
Al3++3OHˉ=Al(OH)3↓
C
H+、Fe2+、SO42ˉ、NO3ˉ
BaCl 2溶液
SO42ˉ+Ba2+=BaSO4↓
D
Na+、K+、ClOˉ、SO42ˉ
通入少量SO2
2ClOˉ+SO2+H2O=2HClO+SO32ˉ
难度: 困难查看答案及解析
-
下列说法正确的是
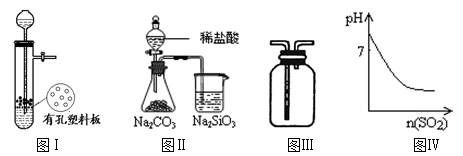
A.图I所示装置用于Cu和浓H2SO4制取少量的SO2气体
B.图Ⅱ装置可验证非金属性:Cl>C>Si
C.图Ⅲ可用于收集气体H2、CO2、Cl2、NH3
D.图Ⅳ表示将SO2气体通入溴水中,所得溶液的pH变化
难度: 中等查看答案及解析
-
已知电离平衡常数:H2CO3>HClO>HCO3-,下列有关叙述中,正确的是
①若KI溶液中混有Br-,加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成。
②向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
③向NaClO溶液中通入少量二氧化碳的离子反应方程式:2ClO-+CO2+H2O===2HClO+CO32—
④海水提溴过程中,用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为
3Br2+6CO32-+3H2O=5Br-+ BrO3-+6HCO3-
A.② ④ B.① ③ C.② ③ D.① ④
难度: 困难查看答案及解析
-
已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3•H2O,向含有等物质的量NH4Cl、AlCl3和HCl混合溶液中慢慢滴加NaOH溶液至过量,并不断搅拌,可能发生以下离子反应:①H++OH-=H2O;②Al(OH)3+OH-=AlO2-+2H2O;③Al3++3OH-=Al(OH)3↓;④NH4++OH-=NH3•H2O;⑤NH4++AlO2-+2H2O=Al(OH)3↓+NH3•H2O.其正确的离子反应顺序是
A.①③②④ B.①③④② C.①③②⑤ D.①④③②
难度: 困难查看答案及解析
-
下列有关元素周期表和元素周期律的说法中,正确的是
A.第三周期主族元素中氯的原子半径最大
B.原子最外层电子数为2的元素一定位于周期表中的第ⅡA族
C.同主族自上而下,其非金属元素气态氢化物的稳定性逐渐增强
D.镓(Ga)位于第4周期、ⅢA族,其最高价氧化物对应水化物的化学式为Ga(OH)3
难度: 中等查看答案及解析
-
在酸性条件下,向含有铬废水中加入FeSO4,可将有害的Cr2O72-转化为 Cr3+,然后再加入熟石灰调节溶液的pH,使Cr3+转化为Cr(OH)3沉淀,而从废水中除去.下列说法正确的是
A.FeSO4在反应中作氧化剂
B.随着反应的进行,该废水的pH会减小
C.若该反应转移0.6mol e-,则会有0.2mol Cr2O72- 被还原
D.除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应
难度: 中等查看答案及解析
-
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。
难度: 中等查看答案及解析
-
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法正确的是
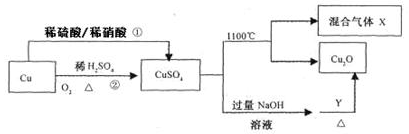
A.途径①和途径②都体现了硫酸的酸性和氧化性
B.Y可以是酒精溶液
C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体
D.将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体
难度: 中等查看答案及解析
-
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol/L和2 mol/L,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO)
A.0.448 L B.0.672 L C.0.896 L D.0.224 L
难度: 中等查看答案及解析
-
向18.4g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3g沉淀.另取等质量的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为
A.7.84L B.6.72L C.4.48L D.无法计算
难度: 中等查看答案及解析