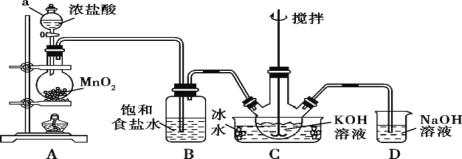
-
化学与生活息息相关,下列有关说法错误的是( )
A. 苏打水是Na2CO3饱和溶液,可以缓解胃酸过多
B. 明矾净水,利用了Al(OH)3胶粒的吸附性质
C. 铁粉可以用于食品保鲜,涉及到Fe的还原性
D. 碘酒在处理伤口时,应用了I2的氧化性
难度: 简单查看答案及解析
-
光化学烟雾是汽车尾气在紫外线作用下生成的有害浅蓝色烟雾,由氮的氧化物和烃类等一次污染物,与它们发生一系列光化学反应生成的臭氧、醛类、过氧乙酰硝酸酯(PAN)等二次污染物组成。光化学烟雾导致眼睛及粘膜受刺激,引发呼吸道疾病,严重时使人头痛、呕吐,甚至死亡。下列叙述中错误的是( )

A. 光化学烟雾的分散剂为空气
B. NO2为酸性氧化物
C. O2转化成O3的反应为非氧化还原反应
D. 汽车节能减排措施可以缓解光化学烟雾带来的污染
难度: 中等查看答案及解析
-
下列各项叙述中,正确的是( )
A. 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
B. 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
C. 24Cr原子的电子排布式是1s22s22p63s23p63d44s2
D. 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
① 1s22s22p63s23p4 ② 1s22s22p63s23p3 ③ 1s22s22p3 ④ 1s22s22p5
则下列有关比较中正确的是( )
A. 最高正化合价:④>③=②>①
B. 电负性:④>③>②>①
C. 原子半径:④>③>②>①
D. 第一电离能:④>③>②>①
难度: 中等查看答案及解析
-
NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A. 标准状况下,4.48 L SO3中含有O原子个数为0.6 NA
B. 常温常压下,1 L 0.1 mol/L CH3CH2OH溶液中含有H原子数目为0.6 NA
C. 熔融状态下,0.2 mol NaHSO4中阴阳离子个数之和为0.6 NA
D. 一定条件下,N2与H2充分反应得到3.4 g NH3,转移电子数为0.6 NA
难度: 中等查看答案及解析
-
下列说法正确的是(NA为阿伏加德罗常数)( )
A. 12 g石墨中含有C—C键的个数为1.5 NA
B. 12 g金刚石中含有C—C键的个数为4 NA
C. 60 g SiO2中含有Si—O键的个数为2 NA
D. 124 g P4中含有P—P键的个数为4 NA
难度: 困难查看答案及解析
-
下列选项对离子方程式的判断合理的是( )
反应物
离子方程式
判断
A.Al2O3与足量的NaOH溶液反应
2Al2O3+2OH-=4AlO2-+H2↑
正确
B.NH4HCO3与足量的NaOH溶液反应
HCO3-+OH-=CO32-+H2O
正确
C.Ca(HCO3)2溶液与足量NaOH溶液反应
Ca2++HCO3-+OH-=CaCO3↓+H2O
错误
D.FeBr2溶液与等物质的量的的Cl2反应
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
错误
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列描述正确的是( )
A. 水加热到很高温度都难分解是因水分子间存在氢键
B. C2H2分子中σ键与π键的数目比为1∶1
C. CS2为V形极性分子
D. SiF4与SO32-的中心原子均为sp3杂化
难度: 中等查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是( )
A. 在[Cu(NH3)4]2+中,Cu2+提供孤对电子,NH3提供空轨道
B. 沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4]2+
C. 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
D. 向反应后的溶液加入乙醇,溶液没有发生变化
难度: 中等查看答案及解析
-
为鉴别某种白色固体样品成分,进行如下实验:
①取少量样品加入足量水后充分搅拌,样品未全部溶解;再加入足量稀盐酸,有无色气体生成,固体全部溶解;
②取少量样品加入足量稀硝酸后充分搅拌,样品未全部溶解。
该白色固体样品成分可能为
A. Al2(SO4)3,NaHCO3 B. CaCO3,CuCl2
C. AgCl,Na2CO3 D. BaCl2,Na2SO3
难度: 中等查看答案及解析
-
下列有关离子晶体的数据大小比较不正确的是( )
A. 晶格能:NaF>NaCl>NaBr
B. 硬度:MgO>CaO>BaO
C. 熔点:NaF>MgF2>AlF3
D. 阴离子的配位数:CsCl>NaCl>CaF2
难度: 中等查看答案及解析
-
由下列实验操作及现象,可以推出相应结论的是( )
实验操作
实验现象
实验结论
A.
溶液中加入K3[Fe(CN)6]
有蓝色沉淀生成
溶液中含有Fe2+
B.
向样品溶液中加入淀粉溶液
溶液变为蓝色
溶液中含有I-
C.
向样品溶液中加入BaCl2溶液,再加入稀盐酸
有白色沉淀生成
溶液中含有SO42-
D.
向样品溶液中加入过量稀盐酸
生成气体使品红溶液褪色
溶液中含有SO32-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图是Mn和Bi形成的某种晶体的晶胞结构示意图,则该晶体的化学式可表示为( )
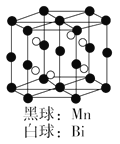
A. Mn4Bi3
B. Mn2Bi
C. MnBi
D. MnBi3
难度: 中等查看答案及解析
-
将NaAlO2、Ba(OH)2、NaOH配成100.0 mL混合溶液,向该溶液中通入足量CO2,生成沉淀的物质的量n(沉淀),与通入CO2的体积(标准状况下)V(CO2)的关系,如下图所示,

下列说法中正确的是( )
A. P点的值为12.32
B. 混合溶液中c(NaOH)+c(NaAlO2)=4.0 mol/L
C. bc段的化学反应方程式为:NaOH+CO2=NaHCO3
D. cd段表示Al(OH)3沉淀溶解
难度: 困难查看答案及解析