-
生活是化学的源泉,下列有关生活中的化学叙述错误的是
A.宇宙飞船中使用的碳纤维,是一种新型无机非金属材料
B.不可用铝制餐具长时间存放酸性、碱性食物
C.明矾可用于净水,氢氧化铝常用于治疗胃病
D.日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应
难度: 中等查看答案及解析
-
某微粒用Xn+表示,下列关于该微粒的叙述正确的是
A.所含质子数= A-n B.所含电子数=Z+n
C.所含中子数=A-Z D.质量数=Z+A
难度: 中等查看答案及解析
-
下列各组元素中,按最高正价递增顺序排列的是
A.C、N、O、F B.Li、Na、K、Rb
C.F、Cl、Br、I D.K、Mg、C、S
难度: 中等查看答案及解析
-
下列有关化学用语正确的是
A.NH4Cl的电子式:
Cl-
B.N2的电子式:
C.S原子的结构示意图:
D.质子数为26、中子数为30的铁原子:Fe
难度: 中等查看答案及解析
-
下列叙述正确的是
A.金属元素和非金属元素形成的化合物一定是离子化合物
B.18O2和18O3互为同素异形体,相同状况下其密度之比为2∶3
C.过渡元素都是副族元素
D.同主族元素的原子最外层电子数相同,化学性质也相同
难度: 中等查看答案及解析
-
在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+=3R2+3H2O,下列关于R元素的叙述中,正确的是
A.元素R位于周期表中第ⅤA族
B.R可能是金属
C.R形成的单质在常温常压下一定是气体
D.反应中氧化产物与还原产物的物质的量之比是5:1
难度: 中等查看答案及解析
-
镁、铝单质的化学性质以相似性为主,但也存在某些较大差异性,下列物质能用于证明二者存在较大差异性的是
①CO2 ②盐酸 ③NaOH溶液 ④水
A.①④ B.②③ C.①③ D.②③④
难度: 中等查看答案及解析
-
下列事实不能作为实验判断依据的是
A.硫酸的酸性强于次氯酸,判断硫与氯的非金属性强弱
B.镁与铝分别与物质的量浓度相同的盐酸反应,判断镁与铝的金属活动性强弱
C.钠和镁分别与冷水反应,判断金属活动性强弱
D.Cl2与Br2分别与足量的H2反应,判断氯与溴的非金属性强弱
难度: 中等查看答案及解析
-
下列每组中各物质内既有离子键又有共价键的一组是
A.Na2O2、KOH、Na2SO4 B.MgO、Na2SO4、NH4HCO3
C.NaOH、H2SO4、(NH4)2SO4 D.HCl、Al2O3、MgCl2
难度: 中等查看答案及解析
-
下列说法正确的是
A.Cu→CuO→Cu(OH)2每步转化均能通过一步反应实现
B.铝合金是一种混合物,它比纯铝的熔点高
C.金属铜放置在潮湿的空气中会被锈蚀,生成绿色的铜锈——碱式碳酸铜
D.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
难度: 中等查看答案及解析
-
某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.强酸性溶液:Mg2+、K+、SO42-、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C.0.1mol·L-1AgNO3溶液:H+、K+、SO42-、I-
D.0.1mol·L-lNaAlO2溶液:H+、Na+、Cl-、SO42-
难度: 中等查看答案及解析
-
下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是
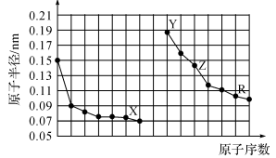
A.X、Y分别是O、Na元素
B.R的单质与足量X2反应生成RX3
C.Z的氧化物熔点很高,是较好的耐火材料
D.电解熔融的Z的氧化物可以得到单质Z
难度: 困难查看答案及解析
-
四种短周期元素A、B、C、D的原子序数依次增大,其中A与C,B与D同主族。常温下A的单质是密度最小的气体;B的最高正价与最低负价的代数和为0。下列判断正确的是
A.A、C两种元素组成的化合物CA为共价化合物
B.B元素可形成多种同素异形体
C.C元素存在多种核素
D.D的氧化物是两性氧化物
难度: 中等查看答案及解析
-
某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
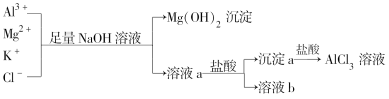
下列说法正确的是
A.NaOH溶液可以用氨水来代替 B.沉淀a为NaAlO2
C.溶液b中只含有NaCl D.向溶液a中滴加盐酸需控制溶液的pH
难度: 中等查看答案及解析
-
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断错误的是
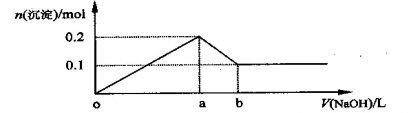
A.NaOH的浓度为0.6 mol·L-1 B.在a点处溶液中的溶质为NaCl
C.混合溶液中n(Al3+)∶n(Mg2+)=2∶1 D.图中线段oa : ab=5∶1
难度: 中等查看答案及解析