-
下列关于物质的分类或变化说法正确的是
A.稀硫酸、NaCl溶液是实验室常见的强电解质
B.二氧化氮经加压凝成无色液体为物理变化
C.Na2O·SiO2是一种简单的硅酸盐,可溶于水
D.溴水滴入植物油中振荡褪色,说明溴被植物油从溴水中萃取出来
难度: 中等查看答案及解析
-
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号
甲
乙
丙
①
CO2
SO2
石灰水
②
HCl
CO2
石灰水
③
CO2
SO2
Ba(NO3)2
④
NO2
SO2
BaCl2:
⑤
CO2
NH3
CaCl2
A.②③④ B.②③④⑤ C.①③④ D.①②③④
难度: 中等查看答案及解析
-
下列说法正确的是
A.非金属单质中一定存在共价键;
B.金属元素和非金属元素形成的化合物一定是离子化合物;
C.含共价键的化合物不一定是共价化合物;
D.溶于水能导电的化合物就是离子化合物
难度: 简单查看答案及解析
-
在中学化学实验中,对某些化学试剂进行循环使用,可以节省资源、减少污染、降低成本。下列做法不合理的是
选项
实验名称
回收试剂
回收方法
回收后用途
A
加热KClO3与MnO2
制氧气
二氧化锰
溶解、过滤、洗涤、干燥
重复使用
B
过氧化钠与水反应
氯化钠
加入过量盐酸、蒸发、结晶
制取实验备用
C
用CCl4萃取溴水中的溴
四氯化碳
碱液洗涤、分液
重复使用
D
浓硫酸的稀释
稀硫酸
直接密封保存
制氢气、硫酸盐等
难度: 简单查看答案及解析
-
下列说法正确的是
A.原子的最外层电子数等于族序数
B.主族元素X、Y能形成XY3型化合物,序数差可能为2、6或8
C.分子结构相似的分子相对分子质量越大熔沸点越高
D.元素的原子得电子越多非金属性越强,失电子越多,金属性越强
难度: 简单查看答案及解析
-
有a、b、c、d、e五种气体,现进行下列实验:
(1)a和b混合
气体变红棕色
(2)c和d混合
产生白烟
(3)c和e分别通入少量溴水中
溴水都变成无色透明的液体
(4)b和e分别通入氢硫酸中
都产生淡黄色浑浊
则a、b、c、d、e依次可能是
A.O2、NO、HCl、NH3、CO2 B.O2、NO、NH3、HCl、SO3
C.NO、O2、NH3、HCl、SO2 D.HCl、CO2、NH3、H2S、CH4
难度: 中等查看答案及解析
-
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
选项
离子组
加入试剂
加入试剂后发生反应的离子方程式
A
NH4+、Fe2+、SO42-
少量Ba(OH)2溶液
2NH4++SO42-+Ba2++2OH-===BaSO4↓+2NH3·H2O
B
Mg2+、HCO3-、Cl-
过量NaOH溶液
Mg2++2HCO3-+4OH-===
2H2O+Mg(OH)2↓+2CO32-
C
K+、NH3·H2O、CO32-
通入少量CO2
2OH-+CO2===CO32-+H2O
D
Fe2+、NO3-、SO32-
NaHSO4溶液
SO32-+2H+===SO2↑+H2O
难度: 困难查看答案及解析
-
某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2===2H2O,正极反应为O2+2CO2+4e-===2CO32-,则下列推断正确的是
A.负极反应为H2+2OH--2e-===2H2O
B.该电池可在常温或高温时进行工作,对环境具有较强的适应性
C.该电池供应2 mol水蒸气,同时转移2 mol电子
D.放电时负极有CO2生成
难度: 中等查看答案及解析
-
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是
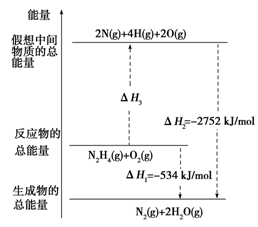
A.194 B.391
C.516 D.658
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值,下列说法正确的是
A.某温度下纯水的pH=6,该温度下10 L pH=11的NaOH溶液中含OH-的数目为NA
B.以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L
C.在反应Zn+2HNO3+NH4NO3===N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子总数等于2NA
D.5.4 g Al分别与含溶质0.2 mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA
难度: 简单查看答案及解析
-
下列分子结构中,所有原子都满足最外层为8电子结构的是
A. 氯化硫(S2Cl2 ) B.次氯酸 C. 二氟化氙 D. 三氟化硼
难度: 中等查看答案及解析
-
10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列物质,能加快反应速率但又不影响氢气生成的是
A.KNO3 B.CH3COONa C.CuSO4 D.Na2CO3
难度: 简单查看答案及解析
-
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
编号
a
b
c
d
①
Na2O
Na2O2
Na
NaOH
②
Al2O3
NaAlO2
Al
Al(OH)3
③
FeCl2
FeCl3
Fe
CuCl2
④
NO
NO2
N2
HNO3
A.①② B.②③ C.②④ D.①③
难度: 中等查看答案及解析
-
室温下,将0.20mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
加入的物质
结论
A
100mL 2mol·L-1H2SO4
反应结束后,c(Na+)<c(SO42-)
B
0.20molCaO
溶液中
增大
C
200mL H2O
由水电离出的c(H+)·c(OH-)不变
D
0.4molNaHSO4固体
反应完全后,溶液pH减小,c(Na+)不变
难度: 中等查看答案及解析
-
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。
已知:CH3OH(l)+O2(g)= CO(g)+2H2O(g)
= -443.64 kJ·mol-1
2CO(g)+ O2(g)= 2CO2(g)
= -566.0kJ·mol-1
下列说法或热化学方程式正确的是
A.CO的燃烧热为566.0 kJ·mol-1
B.2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低
C.完全燃烧20g甲醇,生成二氧化碳和液态水时放出的热量为908.3 kJ
D.2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)
=-1453.28 kJ·mol-1
难度: 中等查看答案及解析
-
X、Y、Z、W、R属于短周期主族元素。X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m—n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。 下列叙述错误的是
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y的氢化物比R的氢化物稳定,熔沸点高
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D.RY2、WY2通入BaCl2溶液中均有白色沉淀生成。
难度: 困难查看答案及解析