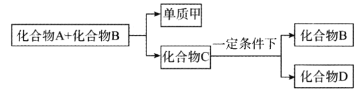
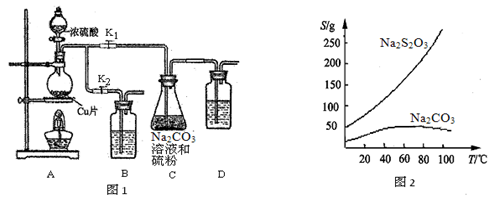
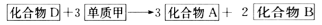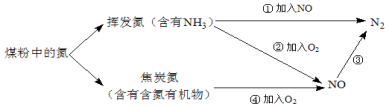-
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O7 2-(橙色)+ H2O
2H++ 2CrO42- (黄色),①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O7 2- + 14H++ 6Fe2+
2Cr3+(绿色) + 6Fe3+ + 7H2O。下列分析正确的是
A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
B.实验②能说明氧化性:Cr2O7 2-> Fe3+
C. CrO42- 和Fe2+在酸性溶液中可以大量共存
D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
难度: 极难查看答案及解析
-
常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
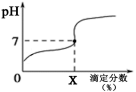
A.HA溶液加水稀释后,溶液中
的值减小
B.HA的电离常数
(x为滴定分数)
C.当滴定分数为100时,溶液中水的电离程度最大
D.滴定分数大于100时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是
A.浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体
B.二氧化硫具有漂白性,可用于加工食品使食品增白
C.铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料
D.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸
难度: 中等查看答案及解析
-
我国科研人员以蹄叶橐吾为原料先制得化合物Ⅰ,再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示。下列有关说法不正确的是
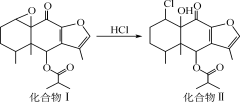
A.化合物Ⅰ能使酸性KMnO4溶液褪色
B.化合物Ⅰ分子中含有4个手性碳原子
C.化合物Ⅱ一定条件下能发生取代、消去及加成反应
D.检验化合物Ⅱ是否含化合物Ⅰ可用Br2的CCl4溶液
难度: 困难查看答案及解析
-
在2 L密闭容器中将4 mol气体A和2 mol气体B混合,在一定温度下发生反应:3A(g)+2B(g)
xC(g) + 2D(g)。 2 min后达到平衡时生成1.6 mol C,又测得反应速率v(D)= 0.2 mol/(L • min),下列说法正确的是
A.x=4
B.B的转化率为60%
C.A的平衡浓度是2.8 mol/L
D.平衡时气体的压强是原来的0.94倍
难度: 困难查看答案及解析
-
下列对有机物结构的描述错误的是
A.甲烷与氯气的混合气体在光照下生成的有机化合物均无同分异构体
B.组成为C7H16的烷烃中仅能由一种单烯烃加氢而制得的有2种
C.某烃的结构简式可表示为
 (碳原子数≤10)。已知分子中有两种化学环境不同的氢原子,且数目之比为3∶2,则该烃一定是苯的同系物
(碳原子数≤10)。已知分子中有两种化学环境不同的氢原子,且数目之比为3∶2,则该烃一定是苯的同系物D.含5个碳原子的有机物,每个分子中最多可形成4个C—C键
难度: 困难查看答案及解析
-
从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是
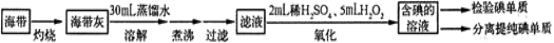
A.在灼烧过程中使用的仪器只有酒精灯、三脚架、泥三角、烧杯、玻璃棒
B.在上述氧化过程中发生反应的离子方程式为2I-+H2O2
I2+2OH-
C.在提取碘单质时,用酒精作萃取剂
D.在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出
难度: 中等查看答案及解析