-
(14分)Na2S2O3可做分析试剂。它易溶于水,遇酸易分解。某研究小组进行如下实验:
【实验一】Na2S2O3·5H2O的制备
I 实验原理:Na2SO3(aq)+S(s)△ Na2S2O3(aq)
II 实验装置:如图1所示,有关物质的溶解度曲线如图2所示:
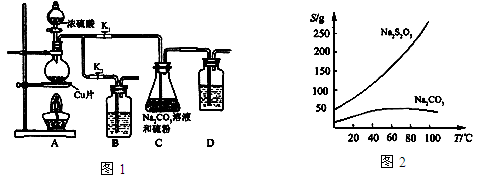
III 实验步骤:
(1)检查装置气密性,按图1所示加入试剂,其中装置B和D中加的是 ,装置C中的硫粉应事先研细并用乙醇润湿,否则会影响 。
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内发生反应的化学方程式: 。C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热。采取该措施的理由是 。
(4)将C中的混合液过滤,将滤液经过 、 、过滤、洗涤、烘干,可得粗产品Na2S2O3·5H2O。
IV 产品检测:
(5)粗产品中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
【实验二】自来水中余氯的测定
含氯消毒剂给自来水消毒后有余氯。测定自来水中余氯含量的方案如下:在250ml碘量瓶中(或具塞锥形瓶中)放置0.5g碘化钾,加10ml稀硫酸,准确量取流动水样100ml(打开自来水龙头,待水流数十秒后再取水样)置于碘量瓶,迅速塞上塞摇动,见水样呈淡黄色,加1ml淀粉溶液变蓝,则说明水样中有余氯。再以C mol/L标准Na2S2O3溶液滴定,至溶液蓝色消失呈无色透明溶液,记下硫代硫酸钠溶液的体积。
(已知:滴定时反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6)
(6)若该自来水是以漂白粉消毒,能说明水样中有余氯的反应离子方程式为 。
(7)按上述方案实验,消耗标准Na2S2O3溶液V mL,该次实验测得自来水样品中余氯量(以游离Cl2计算)为____ mg·L-1。在上述实验过程中,若“塞上塞摇动”动作不够迅速,则测得结果 (填“偏高”“偏低”或“不变”)。
-
(14分)Na2S2O3可做分析试剂。它易溶于水,遇酸易分解。某研究小组进行如下实验:
【实验一】Na2S2O3·5H2O的制备
I 实验原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
II 实验装置:如图1所示,有关物质的溶解度曲线如图2所示:
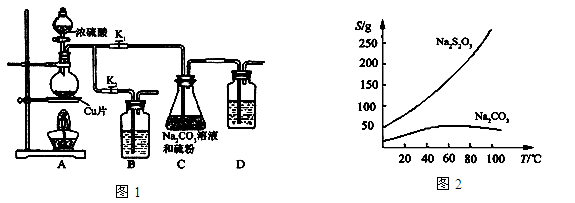
III 实验步骤:
(1)检查装置气密性,按图1所示加入试剂,其中装置B和D中加的是 ,装置C中的硫粉应事先研细并用乙醇润湿,否则会影响 。
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热。采取该措施的理由是 。
(4)将C中的混合液过滤,将滤液经过一系列操作,可得粗产品Na2S2O3·5H2O。
IV 产品检测:
(5)粗产品中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
【实验二】自来水中余氯的测定
含氯消毒剂给自来水消毒后余氯含量的方案如下:在250ml碘量瓶(或具塞锥形瓶)中放置0.5gKI,加10ml稀硫酸,准确量取流动水样100ml(打开自来水龙头,待水流数十秒后再取水样)置于碘量瓶,迅速塞上塞摇动,见水样呈淡黄色,加1ml淀粉溶液变蓝,则说明水样中有余氯。再以Cmol/L标准Na2S2O3溶液滴定,至溶液蓝色消失呈无色透明溶液,记下硫代硫酸钠溶液的体积。
(已知:滴定时反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6)
(6)若该自来水是以漂白粉消毒,能说明水样中有余氯的反应离子方程式为 。
(7)上述实验,消耗标准Na2S2O3溶液V mL,则自来水样品中余氯量(以游离Cl2计算)为 mg·L-1。实验中,若“塞上塞摇动”动作缓慢,则测得结果 (填“偏高”“偏低”或“不变”)。
-
Na2S2O3可做分析试剂。它易溶于水,遇酸易分解。某研究小组进行如下实验:
【实验一】Na2S2O3·5H2O的制备
I实验原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
II实验装置:如图1所示,有关物质的溶解度曲线如图2所示:
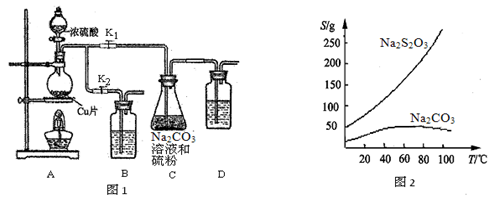
Ⅲ实验步骤:
(1)检查装置气密性,按图1所示加入试剂,其中装置B和D中加的是 ,装置 C中的硫粉应事先研细并用乙醇润湿,否则会影响 。
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内发生反应的化学方程式: 。C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热。采取该措施的理由是 。
(4)将C中的混合液过滤,将滤液经过 、 、过滤、洗涤、烘干,可得粗产品Na2S2O3·5H2O。
IV产品检测:
(5)粗产品中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
【实验二】自来水中余氯的测定
含氯消毒剂给自来水消毒后有余氯。测定自来水中余氯含量的方案如下:在250ml碘量瓶中(或具塞锥形瓶中)放置0.5g碘化钾,加10mL稀硫酸,准确量取流动水样100mL(打开自来水龙头,待水流数十秒后再取水样)置于碘量瓶,迅速塞上塞摇动,见水样呈淡黄色,加1mL淀粉溶液变蓝,则说明水样中有余氯。再以cmol/L标准Na2S2O3溶液滴定,至溶液蓝色消失呈无色透明溶液,记下硫代硫酸钠溶液的体积。(已知:滴定时反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6)
(6)若该自来水是以漂白粉消毒,能说明水样中有余氯的反应离子方程式为 。
(7)按上述方案实验,消耗标准Na2S2O3溶液VmL,该次实验测得自来水样品中余氯量(以游离Cl2计算)
为 mg·L-1。在上述实验过程中,若“塞上塞摇动”动作不够迅速,则测得结果 (填“偏高”、“偏低”或“不变”)。
-
硫代硫酸钠(Na2S2O3·5H2O),又名大苏打、海波,主要用于照相业作定影剂、作鞣革时重铬酸盐的还原剂,易溶于水,遇酸易分解。其工艺制备流程如下:
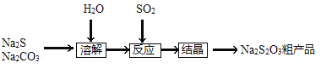
某化学兴趣小组同学模拟该流程设计了如下实验装置:
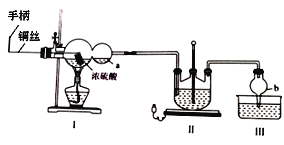
回答下列问题:
(1)双球管a处的液体可用来检验I中的反应是否发生,选用的试剂是______(填字母)
a、品红溶液 b、NaOH溶液 c、稀硫酸
若要停止I中的化学反应,除停止加热外,还要采取的操作是___________________。
(2)加热I,使反应完全,发现浸入液面下的铜丝变黑,甲同学对黑色生成物提出如下假设:①可能是Cu2O;②可能是CuO;③可能是CuS;④CuS和CuO的混合物。乙同学提出假设①一定不成立,该同学的依据是____________________________________;丙同学做了如下实验来验证黑色物质的组成:

基于上述假设分析,原黑色物质的组成为____________________(填化学式)。
(3)II中发生反应的化学方程式为_____________________,实验中通入的SO2不能过量,可能的原因是______________________________________________________。
(4)丁同学提出上述实验装置的设计存在不足,建议在I上_____________;在I、II之间增加_____________。
-
硫代硫酸钠晶体(Na2S2O3•5H2O)易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业上制取硫代硫酸钠晶体,反应装置和试剂如下图:
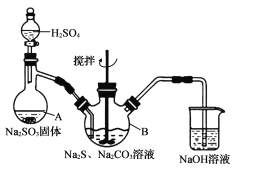
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀地通人Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
回答下列问题:
(l)仪器A的名称是____,Na2S的电子式为____。
(2)三颈烧瓶B中制取Na2S203反应的总化学方程式为_______________
(3)从上述生成物混合液中获得较高产率Na2S2O3.5H2O的步骤为
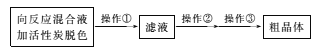
为减少产品的损失,操作①为趁热过滤,“趁热”的目的是____;操作②是____;操作③是抽滤、洗涤、干燥。
(4)测定Na2S203.5H2O纯度取6.00 g产品,配制成100 mL溶液。取10. 00 mL溶液,以淀粉溶液为指示剂,用浓度0. 0500 mol/L的标准溶液进行滴定,反应原理为2S2O32-+I2 S4O62-+2I-,相关数据记录如下表所示。
S4O62-+2I-,相关数据记录如下表所示。
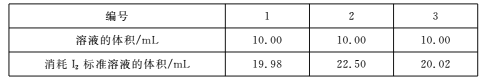
Na2S203•5H20的纯度为____%(保留1位小数)。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为________________________________________
-
硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”,又称“海波”。已知它易溶于水,难溶于乙醇,加热易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
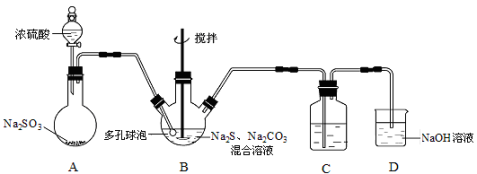
(1)装置A中发生反应的化学方程式是 。
(2)装置B中通入SO2反应生成Na2S2O3和CO2,其离子方程式为 ,生成的硫代硫酸钠粗品可用 洗涤。
(3)装置C的作用是检验装置B中SO2的吸收效率,C中试剂是 ,表明SO2吸收效率低的实验现象是C中溶液 。为了使SO2尽可能吸收完全,在不改变B中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 (写出一条)。
(4)本实验所用的Na2CO3中含少量NaOH,检验含有NaOH的实验方案为: (实验中供选用的试剂及仪器: CaCl2溶液、Ca(OH)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管。提示:室温时CaCO3饱和溶液的pH=9.5)
-
硫代硫酸钠是一种重要的化工产品。某兴趣小组制备硫代硫酸钠晶体(Na2S2O3·5H2O)的实验装置如下图所示(省略夹持装置):
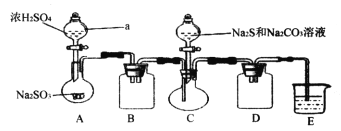
主要实验步骤为:①检查装置气密性,按图示加入试剂;②先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4;③待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经一系列实验操作后得到产品。
已知:i.Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;
ⅱ.向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
回答下列问题:
(1)仪器a的名称是________;B、D装置的作用_______________。
(2)上述实验步骤③中的操作主要有_______、冷却结晶、过滤、洗涤、干燥;E中的试剂是____。
(3)为检验产品中是否含有Na2SO3和Na2SO4,该小组设计了以下实验方案(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择),请将方案补充完整:
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,向沉淀中滴加足量的_______,若___________(填实验现象),则可以确定产品中含有Na2SO3和Na2SO4。
(4)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤②需进行改进,具体操作是______________________;写出制备Na2S2O3的总反应的化学方程式:________。
(5)称取样品29.l0g,配成500mL溶液,取出250mL向其中加入足量稀硫酸,充分反应,静置、过滤、洗涤、干燥、称量得沉淀1.60g,则样品中硫代硫酸钠晶体的百分含量为____。
-
硫代硫酸钠(Na2S2O3)是重要的化工原料,可用作分析试剂及鞣革的还原剂,易溶于水,受热、遇酸易分解。Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。工业上常利用含硫废水生产Na2S2O3·5H2O,某化学兴趣小组在实验室中用如图所示装置(加热装置及部分夹持装置已略去)模拟其生产过程并探究其化学性质。
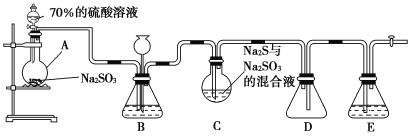
烧瓶C中发生如下反应:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) ①
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) ②
S(s)+Na2SO3(aq) Na2S2O3(aq) ③
Na2S2O3(aq) ③
Ⅰ.制备Na2S2O3·5H2O
(1)加入药品之前须进行的操作是_________;装置D的作用是______________;装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用________(填字母)。
A.蒸馏水 B.饱和Na2SO3溶液
C.饱和NaHSO3溶液 D.饱和NaHCO3溶液
(2)为保证硫代硫酸钠的产量,实验中产生的SO2不能过量,原因是_________;所制得的粗产品可以通过________方法进一步提纯得到纯Na2S2O3·5H2O。
Ⅱ.测定产品纯度
准确称取w g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.10 mol·L-1I2的标准溶液滴定。反应原理为2S2O32-+I2=S4O62-+2I-。
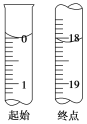
(3)滴定至终点时的现象:______________。滴定起始和终点时I2的标准溶液液面位置如图所示,则消耗I2的标准溶液的体积为________mL。产品的纯度为________(设Na2S2O3·5H2O的相对分子质量为M,列出用M、w表示的表达式)。
Ⅲ.探究Na2S2O3的部分化学性质
(4)(提出假设)
假设一:Na2S2O3与Na2SO4的结构相似,化学性质也应该相似,因此,室温时Na2S2O3溶液的pH=7。
假设二:从S的化合价推测Na2S2O3具有较强的还原性。
(验证假设) 配制适量Na2S2O3溶液,进行如下实验,请将实验补充完整。
| 实验操作 | 实验结论 或现象 | 现象解释(用离子 方程式表示) |
| 假设一 | ________ | 溶液pH=8 | ________ |
| 假设二 | 向溴水中 滴入适量 Na2S2O3 溶液 | 溴水褪色 | ________ |
实验结论:________________________________________。
Ⅳ.Na2S2O3的应用
(5)Na2S2O3的商品名为“海波”,俗称“大苏打”,化学上常用于滴定实验。为测定某K2Cr2O7溶液的浓度,研究小组的同学准确量取10.00 mL K2Cr2O7溶液于锥形瓶中,加入过量KI固体和适量稀H2SO4,滴加几滴指示剂,用0.10 mol·L-1 Na2S2O3标准溶液滴定至终点,进行3次平行实验后,测得平均消耗Na2S2O3溶液的体积为30.00 mL,则c(K2Cr2O7)=________mol·L-1。(已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2S2O32-+I2=S4O62-+2I-)
Ⅴ.探究与反思
(6)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将实验方案补充完整。
取适量产品配成稀溶液,___________________(所需试剂从BaCl2溶液、稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)。
-
(12分)硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:实验具体操作步骤为:
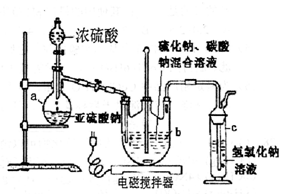
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近
7时,停止通入SO2气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热
浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~45℃左右干燥
50~60min,称量。
请回答以下问题:
(l)仪器a的名称是 ;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因: 。
(3)步骤③中不能将溶液蒸发至干的原因是 ;晶膜通常在溶液表面出现的原因是 。
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是 。
(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol·L-1 KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
则该产品的纯度是____ ,间接碘量法滴定过程中可能造成实验结果偏低的是____ 。
A.滴定管末用Na2S2O3溶液润洗 B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗 D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
-
硫代硫酸钠(Na2S2O3·5H2O) 俗名“大苏打”。易溶于水,难溶于乙醇,沸点为100℃,酸性或加热条件下易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
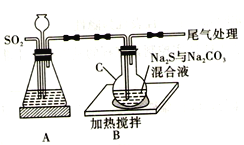
回答下列问题:
(1)装置A可用于观察SO2的生成速率,其中的液体最好选择_____________(填序号)。若装置堵塞使气流不畅,则A中的现象为_______________________________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
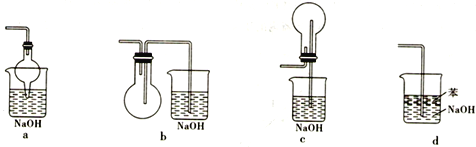
(2)尾气处理可以选择以下装置中的________(填序号)。
(3)反应过程中若pH值小于7则会降低产率,请用离子方程式解释原因:_________________________。
(4)请写出装置C中发生反应的化学方程式:_________________________。
(5)反应结束后,取C中混合物趁热过滤,取滤液于蒸发皿中, ______________,抽滤,洗涤,低温下干燥得产品。洗涤时要尽量减少产品的损失,其具体操作是_________________________。
(6)为检验制得的产品的纯度,该实验小组称取4g 的产品配制成250mL 硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入20mL 0.0lmol·L-1KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配的Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+ S4O62-,实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.2 |
当滴入最后一滴Na2S2O3溶液时,溶液___________,且半分钟内不变化,则达到终点。计算该产品的纯度是____________________________。
Na2S2O3(aq)














