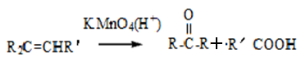-
我国科学家屠呦呦因为发现青蒿素而获得2015年诺贝尔生理和医学奖。已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是
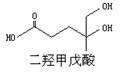
A.二羟甲戊酸的分子式为C6H10O4
B.能发生加成反应,不能发生取代反应
C.在铜的催化下与氧气反应的产物能发生银镜反应
D.1mol该有机物可以与足量金属钠反应产生33.6L H2
难度: 困难查看答案及解析
-
短周期元素A、B、C、D、E的原子序数依次增大,A是原子半径最小的元素,B是地壳中含量最多的元素, A与C同主族,C、D两原子的电子数之和为A、B两原子的电子数之和的3倍。下列叙述正确的是
A.氢化物的热稳定性:D > E
B.原子半径:A<B<C< D< E
C.B与C形成的化合物中不可能含共价键
D.最高价氧化物对应的水化物酸性最强的是E
难度: 困难查看答案及解析
-
在C4H11N中,N原子以三个单键与其他原子相连接,其同分异构体的数目为
A.9 B.8 C.7 D.6
难度: 困难查看答案及解析
-
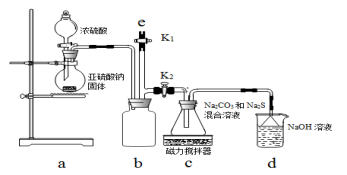
下列实
验装置图与对应的现象或结论的叙述均正确的是
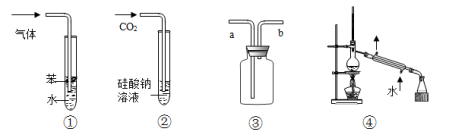
A.装置①:可用于吸收NH3或HCl气体,并防止倒吸
B.装置②:持续通入CO2气体,先出现白色沉淀,后变澄清
C.装置③:若“a进b出”可用于收集NO2,若“b进a出”可用于收集NH3
D.装置④:可用于分离石油,得到汽油、煤油和柴油等各种纯净物
难度: 中等查看答案及解析
-
不同温度下,水溶液中c(H+)与c(OH-)关系如图所示。下列说法正确的是

A.a点对应的溶液中大量存在:Na+、Mg2+、Cl-、SO42-
B.b点对应的溶液中大量存在:Fe2+、Ba2+、Cl-、NO3-
C.c点对应的溶液中大量存在:K+、Al3+、Cl-、CO32-
D.d点对应的溶液中大量存在:Na+、NH4+、ClO-、Cl-
难度: 中等查看答案及解析
-
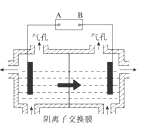
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
),其原理如图所示,下列说法正确的是
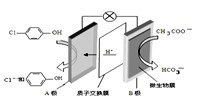
A.A为电池的正极,发生还原反应
B.电流方向从B极沿导线经小灯泡流向A极
C.A极的电极反应式为
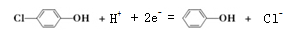
D.当外电路中有0.2mole-转移时,进入A极区的H+的个数为0.2NA
难度: 困难查看答案及解析
-
25℃时,电离常数Ka(HF)=3.6×10-4mol/L,溶度积Ksp(CaF2)=1.46×10-10,Ksp(AgCl)=4×10-10,Ksp(AgI)=1.0×10-16。下列说法正确的是
A.AgCl不能转化为AgI
B.25℃时,0.1mol/L HF溶液pH=l
C.向1L0.1 mol/LHF溶液中加入1L 0.1 mol/LCaCl2溶液,没有沉淀产生
D.25℃时,使AgCl转化为AgI,则加入KI溶液的浓度不低于5×10-12 mol/L
难度: 困难查看答案及解析