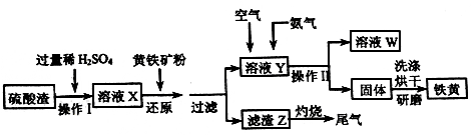-
化学与生活、生产、环境密切相关,下列说法不正确的是
A.黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成
B.炸油条时,常将小苏打和明矾混用做发酵剂
C.大力推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染
D.PM2.5颗粒在大气中可形成气溶胶,具有丁达尔效应
难度: 简单查看答案及解析
-
下列各组离子在指定溶液中可能大最共存的是
A.能使石蕊试液变红色的溶液中:Na+、CO32-、K+、ClO-、I-
B.能与金属铝反应放出H2的溶液中: K+、NO3-、Cl-、NH4+
C.常温下水电离出的c(H+)·c(OH-)=10-20mol/L的溶液中: Na+、Cl-、S2-、SO32-
D.中性溶液:K+、HCO3-、NO3-、SO42-、Fe3+
难度: 困难查看答案及解析
-
NO2、NH3和O2组成的混合气体,在一定条件下恰好完全反应,生成N2和H2O,则原混合气体中NO2、NH3和O2的体积比可能是(不考虑NO2与N2O4之间的转化)
A.2:4:1 B.2:1:2 C.1:1:1 D.1:4:3
难度: 困难查看答案及解析
-
利用下列实验装置进行的相应实验,不能达到实验目的的是
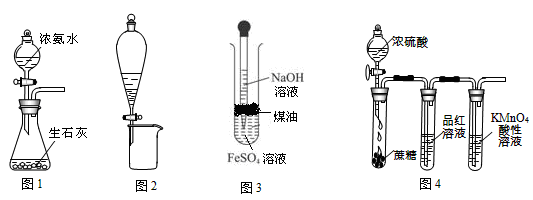
A.图1所示装置可制取氨气
B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液
C.用图3所示装置可制备Fe(OH)2并容易观察到白色沉淀 生石灰 浓氨水
D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
难度: 中等查看答案及解析
-
短周期元素甲、乙、丙、丁在元素周期表中的相对位置如图所示,其中甲是原子半径最小的元素,丙原子最外层有6个电子。下列说法正确的是
A.简单离子半径:r(丁)>r(乙)>r(丙)
B.元素丙的简单气态氢化物的热稳定性比乙的强
C.仅由甲、乙、丙三种元素形成的化合物的水溶液一定呈酸性
D.丙和丁形成的两种化合物中阴阳离子个数比不同
难度: 中等查看答案及解析
-
常温下,下列溶液中的微粒浓度关系正确的是
A.氯气通入氢氧化钠溶液中:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D.某溶液中只存在SO42-、OH-、NH4+、H+四种离子,则可能存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
如下图装置,下列说法正确的是
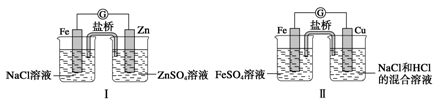
A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+
B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH-
C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大
难度: 困难查看答案及解析
-
下列对应化学反应的离子方程式正确的是
A.KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O=3I2+6OH-
B.向碳酸氢铵溶液中加过量氢氧化钠溶液并加热:NH4++OH-=NH3↑+H2O
C.Na[Al(OH)4]-溶液中通入过量CO2制Al(OH)3:CO2+[Al(OH)4]-= Al(OH)3↓+HCO3-
D.向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
难度: 困难查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是
操作和现象
结论
A
向装有Fe(NO3)2溶液的试管中加入少量稀H2SO4,在管口观察到红棕色气体
溶液中NO3-被Fe2+还原成NO2
B
用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色
该溶液一定是钠盐溶液
C
向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊
有NaHCO3晶体析出
D
常温下,将Al箔插入浓硫酸中,无明显现象
铝和浓硫酸常温不反应
难度: 中等查看答案及解析
-
为了国防现代化,某军事科研所研发了一种新型的Li-SO2Cl2军用电池,其组成结构示意图如图所示。

已知电池总反应为:2Li + SO2Cl2 = 2LiCl + SO2↑。下列说法中不正确的是
A.电池的负极反应为:2Li-2e-=2Li+
B.工作时电流方向:锂电极→导线→负载→碳棒
C.正极电极反应为:SO2Cl2+2e-=2Cl-+SO2↑
D .电池工作时,会在碳棒表面看到气泡产生
难度: 困难查看答案及解析
-
NA为阿伏加德罗常数,下列说法正确的是
A.2L0.5mol/L亚硫酸溶液中含有的H+离子数为2NA
B.18gD2O和18gH2O中含有的质子数均为10NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
难度: 困难查看答案及解析
-
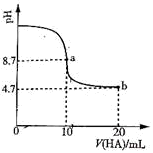
室温下,将浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
的变化如图所示,下列叙述错误的是

①ROH的电离程度:b点大于a点
②MOH的碱性强于ROH的碱性
③当ROH溶液由a点到b点时,
变大
④若两溶液无限稀释,则它们的c(OH-)相等
⑤当
时,若两溶液同时升高温度,则
增大
A.③⑤ B.①⑤ C.①③ D.②④
难度: 困难查看答案及解析
-
如图表示的是难溶氢氧化物在不同pH下的溶解度(S/mol·L-1)。下列说法中正确的是
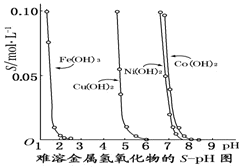
A.pH=3时溶液中铁元素的主要存在形式是Fe3+
B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去
C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右
D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
难度: 困难查看答案及解析
-
常温下,某溶液中由水电离的c(H+)=1×10-3mol/L,该溶液可能是
①NH4Cl溶液,②SO2水溶液,③NaNO3溶液,④NaOH溶液.
A.①④ B.①② C.②③ D.②④
难度: 中等查看答案及解析
-
下列事实不能证明HNO2是弱电解质的是
①用HNO2溶液做导电实验,灯泡很暗
②滴入酚酞,NaNO2溶液显红色
③0.1 mol·L-1HNO2溶液的pH=2
④HNO2与CaCO3反应放出CO2气体
⑤C(H+)=0.1mol·L-1的HNO2溶液稀释至1000倍,PH<4
⑥等pH、等体积的盐酸和HNO2溶液中和碱时,HNO2的中和碱能力强
A.①⑤ B.①④ C.③⑥ D.③④
难度: 中等查看答案及解析