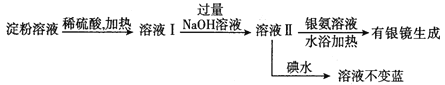
-
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A. 元素非金属性由弱到强的顺序为Y<Z<X
B. Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C. 3种元素的气态氢化物中,Z的气态氢化物最稳定
D. 原子半径由大到小的顺序为Z>Y>X
难度: 中等查看答案及解析
-
“十九大”聚焦绿色发展理念“打赢盐天保卫战,建设美丽中国”。下列有关做法与这一理念不相符的是
A. 将废旧电池进行直接填埋,减少对环境的污染
B. 开发核能、太阳能、风能等新能源,减少对矿物能源的依赖
C. 将煤进行气化处理,溉提高煤的综合利用效率,又可减少酸雨的危害
D. 利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气
难度: 简单查看答案及解析
-
据报道,2012年俄罗斯科学家再次合成117号元素。本次实验生成了6个新原子,其中5个
,1个
。下列关于
和
的说法不正确的是
A. 是元素X的两种不同核素 B. 电子数相差1
C. 中子数分别为176和177 D. 它们互为同位素
难度: 简单查看答案及解析
-
下列变化过程不属于化学变化的是
A. 石油的裂化 B. 油脂的皂化 C. 石油的分馏 D. 煤的干馏
难度: 简单查看答案及解析
-
下列各组物质互为同分异构体的是
A. 氧气和臭氧 B. H2O和D2O C. 乙醇和甲醇 D. 正丁烷和异丁烷
难度: 简单查看答案及解析
-
下列化学用语或模型图表示正确的是
A. 甲烷的球棍模型:
B. S2-的结构示意图:
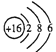
C. 乙烯的结构简式: CH≡CH D. 羟基的电子式:
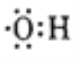
难度: 简单查看答案及解析
-
下列物质只含共价键的是
A. MgCl2 B. N2 C. Na2O2 D. KOH
难度: 简单查看答案及解析
-
下列各有机物分子中,所有原子共处同一平面的是
A. 乙烷 B. 乙醇 C. 甲苯 D. 氯乙烯
难度: 简单查看答案及解析
-
下列属于高分子化合物的是
A. 油脂 B. 氨基酸 C. 淀粉 D. 葡萄糖
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是
A. 铝与稀盐酸的反应
B. 灼热的木炭与CO2反应
C. 甲烷在氧气中的燃烧反应
D. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
难度: 简单查看答案及解析
-
下列每组物质发生状态变化时,克服粒子间的相互作用力属于同种类型的是
A. 食盐和蔗糖熔化 B. 氢氧化钠和单质硫熔化
C. 碘和干冰升华 D. 二氧化硅和氧化钠熔化
难度: 中等查看答案及解析
-
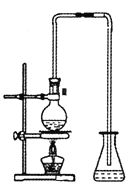
下列实验操作或实验装置(部分仪器已省略) ,正确的是
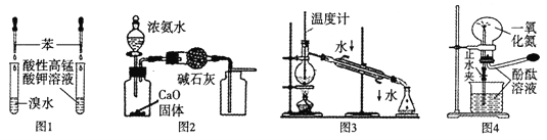
A. 用图1所示装置验证苯中是否有碳碳双键
B. 用图2所示装置制取并收集干燥纯净的NH3
C. 用图3所示装置进行石油的分馏
D. 用图4所示装置演示NO的喷泉实验
难度: 中等查看答案及解析
-
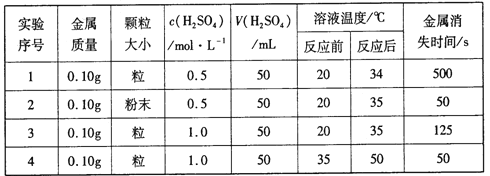
常温下,甲、乙两烧杯盛有同浓度同体积的稀硫酸将纯锌片和纯铜片分别按图示方式插入其中,以下有关实验现象或结论的叙述正确的是
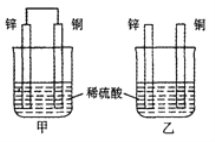
A. 两烧杯中铜片表面均有气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 甲杯溶液的c(H+)减小,乙杯溶液的c(H+)变大
D. 产生气泡的速率甲比乙快
难度: 中等查看答案及解析
-
下列有机反应属于加成反应的是
A.
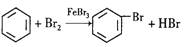
B. CH2=CH2+HCl
CH3CH2Cl
C. CH3COOH + CH3CH2OH
CH3COOCH2CH3+ H2O
D. 2CH3CH2OH +O2
2CH3CHO +2H2O
难度: 简单查看答案及解析
-
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现:
①Si(s) +3HCl(g)
SiHCl3(g) + H2(g) △H= -381kJ/mol
②SiHCl3(g)+H2(g)
S(s) + 3HCl(g)
对上述两个反应的下列叙述中,不正确的是
A. 两个反应都是置换反应 B. 反应②是吸热反应
C. 两个反应互为可逆反应 D. 两个反应都是氧化还原反应
难度: 中等查看答案及解析
-
下列说法正确的是
A. 通过石油的分馏,可直接得到乙烯、丙烯等有机化工原料
B. 煤在空气中加强热得到焦炭等产品的过程叫做煤的干馏
C. 加热杀死流感H7N9病毒是因为其蛋白质受热发生盐析
D.
和
 是同种物质,可证明苯分子中不存在单、双键交替的结构
是同种物质,可证明苯分子中不存在单、双键交替的结构难度: 中等查看答案及解析
-
反应4NH3(g) + 5O2(g)
4NO(g) +6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0. 45mol,则此反应的平均速率
可表示为
A.
=0.010mol/(L·s) B.
=0.0010 mol/(L·s)
C.
=0.0010 mol/(L·s) D.
=0. 0045 mol/(L·s)
难度: 简单查看答案及解析