-
H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,,8.0Dg CH4完全燃烧生成二氧化碳气体和液态水放出444. 8kJ热量。写山该反应的热化学反应方程式:____________________。
(2)为倡导“节能减排”和“低碳经济”, 降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。
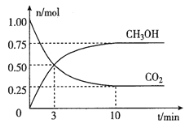
在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) +3H2(g)  CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
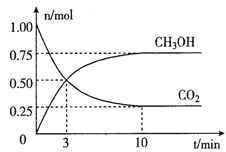
①从反或开始到平衡,CO2的平均反应速率v(CO2)=____。
②达到平衡时,H2的转化率为__________。
③下列措施不能提高反应速率的是__________。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) +2H2(g) CH3OH( g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
CH3OH( g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1mclCH3OH
D. CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
-
H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:___________________________________________。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
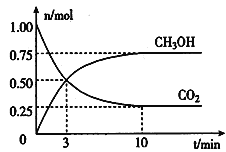
①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________________。
②达到平衡时,H2的转化率为__________。
③该反应的平衡常数K=___________________(表达式)。
④下列措施不能提高反应速率的是__________。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
-
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)CH4既是一种重要的能源,也是一种重要的化工原料。已知 8.0 g CH4完全燃烧生成液态水放出445.15 kJ热量,则其热化学方程式为_____。
(2)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
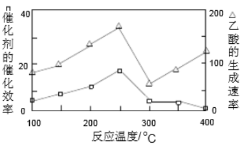
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在_____左右。
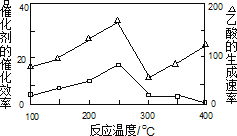
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为_____。
③CH4 还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为 N2和O2,若标准状况下8.96 L CH4可处理22.4 L NOx,则x值为_____。
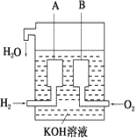
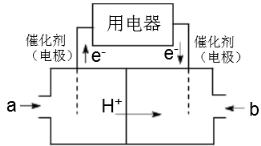
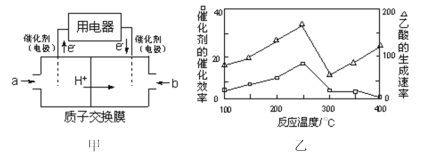
(3)美国阿波罗宇宙飞船上使用了一种新型电池装置,其构造如下图所示,A、B两个电极均由多孔的炭块组成。该电池的负极反应式为:_____。
若该电池工作时增加了1 mol H2O,电路中转移电子的物质的量为_________。
-
(12分)CH4既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0 g CH4完全燃烧生成液体水放出444.8 kJ热量。则
CH4 (g)+2O2(g)=CO2(g)+2H2O(l) ΔH= kJ·mol-1。
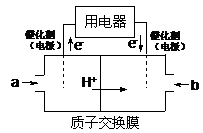
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则通入a气体的电极名称为 ,通入b气体的电极反应式为 。(质子交换膜只允许H+通过)
(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
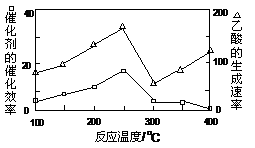
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在 左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为 。
(4)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96 L CH4可处理22.4 L NOx,则x值为 。
-
CH4既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0 g CH4完全燃烧生成液体水放出444.8 kJ热量。则
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=____kJ·mol-1
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理下图所示,则通入a气体的电极名称为 ,通入b气体的电极反应式为 。(质子交换膜只允许H+通过)
(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在 左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为 。
(4)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96L CH4可处理22.4L NOx,则x值为 。
-
CH4既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0 g CH4完全燃烧生成液态水放出444.8 kJ热量。则CH4 (g)+2O2(g)=CO2(g)+2H2O(l) ΔH=____________kJ·mol-1。
(2)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在 ___________左右。
②该反应催化剂的有效成分为偏铝酸亚铜 (CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为 _____________________。
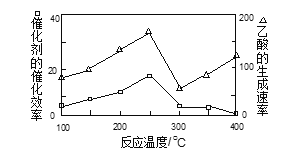
(3)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96 L CH4可处理22.4 L NOx,则x值为_______________。
-
CH4、CH3OH、CO等都是重要的能源,也是重要的化工原料。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成CO和液态水时放出38kJ热量,则该条件下反应2CH4(g)+3O2(g) =2CO(g)+4H2O(l)的ΔH=___。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=___。
②达到平衡时,H2的转化率为___。
(3)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和否H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___。
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和否H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
(4)从烟道气中回收硫是有效处理SO2大气污染的有效方法之一,该方法是在催化剂、773K条件下,CO与SO2反应生成CO2和硫蒸气,该反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:___。

(5)近几年来关于氮污染的治理倍受关注。向工业废水中加入次氯酸钠溶液,可将其中的NH4+完全转化为N2,而次氯酸钠被还原为NaCl。写出上述反应的离子方程式:___。
-
CH4(其中C为-4价)既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0gCH4完全燃烧生成二氧化碳和液态水时放出444.8kJ热量。若一定量的甲烷完全燃烧生成二氧化碳和液态水时放出1334.4kJ的热量,则需要标准状况下的氧气约___L。
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图甲所示,通入2.24L(已换算为标准状况)a气体时,通过质子交换膜转移的H+数目为___(设NA为阿伏加德罗常数的值)。
(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图乙所示,则该反应的最佳温度应控制在___℃左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其反应的离子方程式为___。
③CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2、CO2和H2O,若标准状况下8.96LCH4可处理22.4LNOx,则x值为___。
-
CH4、CH3OH既是重要的化工原料,又是未来重要的能源物质。
(1)将1.0 mol CH4和2.0 mol H2O(g) 通入容积为2L的反应室,在一定条件下发生反应CH4(g)+H2O(g)  CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________。
CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________。
(2)一定条件下,将1.0 mol CH4与2.0 mol H2O(g)充入密闭容器中发生反应CH4(g)+H2O(g)  CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________(填选项序号)。
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________(填选项序号)。
a.恒容条件下充入He b.增大体积
c.升高温度 d.投入更多的H2O(g)
(3)在恒容条件下进行反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________ (填选项序号)。
CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________ (填选项序号)。
a.消耗1 mol CO2同时生成1 mol CH3OH b.容器内压强保持不变
c.混合气体的密度保持不变 d.CH3OH(g)的浓度保持不变
(4)以KOH为电解质的甲醇-空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图。 回答下列问题:
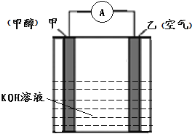
①该原电池的正极是____(填“甲”或“乙”),电解过程中乙电极附近pH____(填“增大”或“减小”);
②负极的电极反应式________________________________。
-
ag 下列物质在氧气中充分燃烧后的气体(1.01×105Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重bg,符合b>a的( )
A.HCHO B.CH3OH C. HOOCCOOH D.纤维素(C6H10O5)n
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。

CH3OH( g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。











