-
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是
A.糖类、蛋白质在一定条件下都能发生水解反应
B.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
C.铝合金的大量使用是因为人们能用焦炭等还原剂从氧化铝中获取铝
D.煤经过气化和液化两个物理变化,可变为清洁能源
难度: 中等查看答案及解析
-
下列实验或实验现象的相关描述中正确的是( )
A.KMnO4(H+)、溴水、FeCl3溶液中分别通入SO2,溶液均褪色
B.乙醇消去反应、酯的水解、蔗糖水解反应均用浓硫酸作催化剂
C.常温下,NO与O2、Cl2与HI、F2与H2均不共存
D.浓硫酸、浓硝酸、新制氯水分别滴在pH试纸上,试纸均出现先变红后褪色现象
难度: 中等查看答案及解析
-
下列说法正确的是
A.酸性溶液中水的电离程度一定比纯水的电离程度小
B.室温下:pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7
C.HA的酸性比HB的强,则Na A溶液的pH一定比NaB溶液的小
D.0.1mol/L Na2CO3溶液和0.1mol/L NaHSO4溶液等体积混合,溶液中c(Na+)> c(SO
) >c(HCO
)> c(OH-)> c(H+)
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.亚硫酸氢钠与硝酸反应:HSO3-+H+= SO2↑+ H2O
B.向氯化银悬浊液中加入浓碘化钠溶液:AgCl+I-=AgI+Cl-
C.碳酸氢铵溶液与少量氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O
D.酸性高锰酸钾溶液与双氧水反应:2MnO4-+5H2O2 +6H+=2Mn 2++O2↑+8H 2O
难度: 中等查看答案及解析
-
三氟化氮(NF3)是微电子工业中优良的刻蚀气体,它在潮湿的环境中能发生反应:
3 NF3 + 5 H2O = 2 NO + HNO3 + 9 HF。下列有关该反应的说法正确的是
A. NF3在潮湿的空气中泄漏时容易被发现
B. NF3是氧化剂,H2O是还原剂
C. 氧化产物与还原产物的物质的量之比为2:1
D. 若转移0.2mol电子时,生成NO气体4.48L
难度: 中等查看答案及解析
-
关于下图所示各装置的叙述中,正确的是
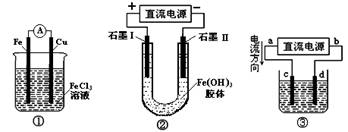
A.装置①是原电池,Fe3+向Fe棒一端移动
B.装置②通电一段时间后石墨Ⅰ电极附近溶液红褐色加深
C.c、d是惰性电极,若用③电解水,电解质溶液可以是Al(NO3)3溶液
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
难度: 中等查看答案及解析
-
下列图像符合题意的是

难度: 中等查看答案及解析