-
下列说法不正确的是
A. 煤是由多种碳氢化合物组成的混合物
B. 萃取在天然香料、药物的提取及核燃料的处理等技术中应用广泛
C. Al(OH)3 胶体能凝聚水中悬浮物,并能吸附色素
D. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
难度: 简单查看答案及解析
-
阿伏加德罗常数的值为NA。下列说法不正确的是
A. 15.6gNa2O2 与过量CO2 反应时,转移的电子数为0.2NA
B. 常温下,5.6g铁粉加入足量浓硝酸中反应,转移的电子数为0.3 NA
C. 常温下,4gCH4 含有NA个C-H 共价键
D. 分子总数为NA的ClO2 和CO2 混合气体中含有的氧原子数为2 NA
难度: 中等查看答案及解析
-
解释下列事实的方程式正确的是
A. 加热可增强纯碱溶液去污能力:CO32﹣+2H2O
H2CO3+2OH﹣
B. 用醋酸溶液除水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
C. 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2
2CO2+2CaSO4
D. 用FeS 除去工业废水中的Hg2+:Hg2++S2-=HgS↓
难度: 困难查看答案及解析
-
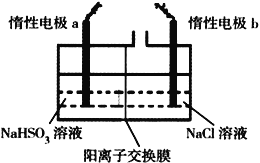
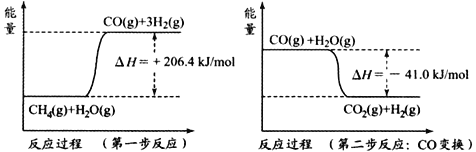
用下图所示实验装置进行相应实验,能达到实验目的的是

A. 若采用装置①铝件镀银,则c 极为铝件,d 极为纯银,电解质溶液为AgNO3溶液
B. 装置②是原电池,能将化学能转化为电能,SO42-移向锌电极
C. 装置③可证明非金属性Cl>C>Si
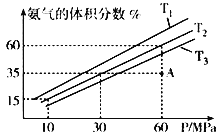
D. 装置④可用于收集氨气,并吸收多余的氨气
难度: 中等查看答案及解析
-
已知X、Y、Z、M、Q 是原子序数依次增大的五种短周期主族元素,其中Z是金属元素,Y 是地壳中含量最高的元素,X、Y、M 在周期表中的相对位置关系如图,下列说法正确的是
X
Y
M
A. 五种元素中原子半径最大的是Q,离子半径最大的是M 离子
B. X、M、Q 三种元素最高价氧化物所对应的水化物的酸性强弱关系为M>Q>X
C. Y 与Z 形成的化合物一定是碱性氧化物
D. Z 与Q 形成的化合物水溶液可能显酸性
难度: 中等查看答案及解析
-
下列检验方法不合理的是
选项
实验
检验方法
A
向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,得Fe(OH)3 胶体
用激光笔照射烧杯中的液体
B
证明溶液中存在NH4+
滴加浓NaOH 溶液,加热,将湿润红色石蕊试纸置于试管口,试纸变蓝
C
区分AgNO3 溶液和Al2(SO4)3 溶液
分别取少量溶液,滴加BaCl2溶液
D
证明氯水中起漂白作用的不是Cl2
用CCl4充分萃取,将红纸条分别浸入分层后的溶液中
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在一定条件下,用石墨电极电解0.5mo/LCuSO4溶液(含H2SO4 ),监测到阳极附近溶液pH随着通电时间的延长而变化,数据如下表所示,下列说法不正确的是
通电前pH
通电后pH
瞬间
20s
40s
60s
80s
100s
120s
……
2.35
2.55
2.50
2.48
2.45
2.41
2.35
2.25
……
A. 通电瞬间,阳离子向阴极移动
B. 电解过程中,阳极发生的电极反应是2H2O-4e-=4H++O2↑
C. 通电后pH 下降过程中,阴极发生的主要电极反应是Cu2++2e-=Cu
D. 通电后pH 下降过程中,H+向阴极的移动速率大于其在阳极的生成速率
难度: 中等查看答案及解析