-
氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是目前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如图:
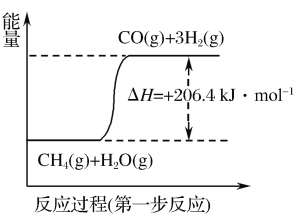
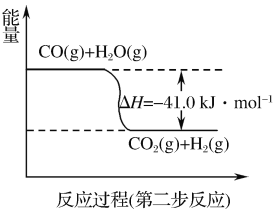
结合图象,写出CH4通过蒸汽转化为CO2和H2的热化学方程式:___。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)。
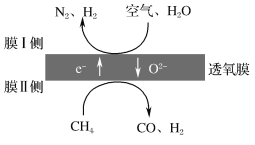
①起还原作用的物质是___。
②膜Ⅰ侧所得气体中 =2,CH4、H2O、O2反应的化学方程式是___。
=2,CH4、H2O、O2反应的化学方程式是___。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。t1 min时达到平衡,在t2 min时改变某一条件,其反应过程如图所示,下列说法正确的是___。
2NH3(g) ΔH<0。t1 min时达到平衡,在t2 min时改变某一条件,其反应过程如图所示,下列说法正确的是___。
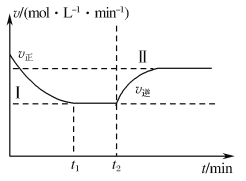
A.Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:φ(Ⅰ)<φ(Ⅱ)
C.Ⅰ、Ⅱ两过程达到平衡的标志是混合气体的密度不再发生变化
D.t2min时改变的条件可以是向密闭容器中加N2和H2的混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器中充入9.0molN2和23.0molH2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图。

①T1、T2、T3由大到小的排序为___。
②在T2、60MPa条件下,A点v正___(填“>”“<”或“=”)v逆,理由是___。
③计算T2、60MPa平衡体系的平衡常数Kp=___MPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留2位有效数字)。
-
氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:
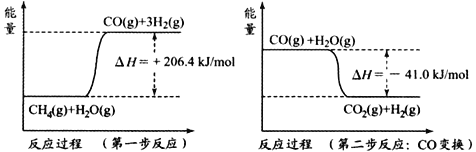
结合图像,写出CH4通过蒸汽转化为CO2和H2的热化学方程式______________________。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)
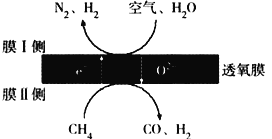
①起还原作用的物质是_________________________。
②膜I侧所得气体 =2,CH4、H2O、O2反应的化学方程式是______________________。
=2,CH4、H2O、O2反应的化学方程式是______________________。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________
2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________
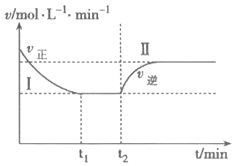
A.Ⅰ、Ⅱ两过程到达平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程到达平衡时,NH3的体积分数:Ⅰ<Ⅱ
C.Ⅰ、Ⅱ两过程到达平衡的标志:混合气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加N2和H2混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器充入9.0mol N2 和23.0mol H2,图为不同温度下平衡混合物中氨气的体积分数与总压强(P )的关系图。
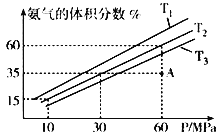
①T1、T2、T3由大到小的排序为______________________________。
②在T2、60MPa条件下,比较A点v正___v逆(填“>”、“<”或“=”),理由是____________。
③计算T2、60Mpa平衡体系的平衡常数Kp=__________。(用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)
-
氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:
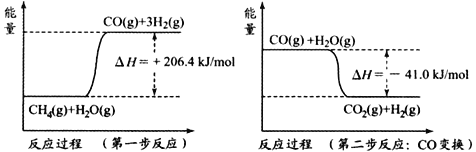
结合图像,写出CH4通过蒸汽转化为CO2和H2的热化学方程式______________________。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)
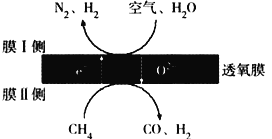
①起还原作用的物质是_________________________。
②膜I侧所得气体 =2,CH4、H2O、O2反应的化学方程式是______________________。
=2,CH4、H2O、O2反应的化学方程式是______________________。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________
2NH3(g) ΔH<0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________
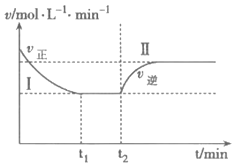
A.Ⅰ、Ⅱ两过程到达平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程到达平衡时,NH3的体积分数:Ⅰ<Ⅱ
C.Ⅰ、Ⅱ两过程到达平衡的标志:混合气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加N2和H2混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器充入9.0mol N2 和23.0mol H2,图为不同温度下平衡混合物中氨气的体积分数与总压强(P )的关系图。

①T1、T2、T3由大到小的排序为______________________________。
②在T2、60MPa条件下,比较A点v正___v逆(填“>”、“<”或“=”),理由是____________。
③计算T2、60Mpa平衡体系的平衡常数Kp=__________。(用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)
-
天然气(以甲烷计)在工业生产中用途广泛。
Ⅰ.在制备合成氨原料气H2 中的应用
(1)甲烷蒸汽转化法制H2的主要转化反应如下:
CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH = +206.2 kJ/mol
CO(g) + 3H2(g) ΔH = +206.2 kJ/mol
CH4(g) + 2H2O(g)  CO2(g) +4H2(g) ΔH = +165.0kJ/mol
CO2(g) +4H2(g) ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是________。
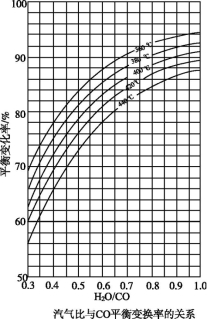
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率
(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如下图所示:
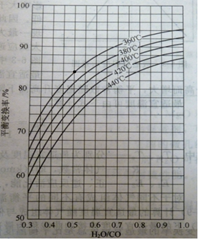
汽气比与CO平衡变换率的关系
析图可知:
① 相同温度时,CO平衡变换率与汽气比的关系是________。
② 汽气比相同时,CO平衡变换率与温度的关系是________。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为:Kp=________。随温度的降低,该平衡常数________(填“增大”“减小”或“不变”)。
Ⅱ.在熔融碳酸盐燃料电池中的应用
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
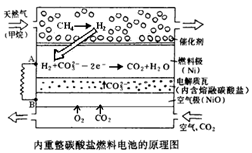
(1)外电路电子流动方向:由________流向________(填字母)。
(2)空气极发生反应的离子方程式是________。
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e‑ 转移,有________ g 精铜析出。
-
天然气(以甲烷计)在工业生产中用途广泛。
(1)Ⅰ.在制备合成氨原料气H2中的应用
(1)甲烷蒸气转化法制H2的主要转化反应如下:
CH4(g)+H2O(g) CO(g)+3H2(g)ΔH=+206.2kJ/mol
CO(g)+3H2(g)ΔH=+206.2kJ/mol
CH4(g)+2H2O(g) CO2(g)+4H2(g)ΔH=+165.0kJ/mol
CO2(g)+4H2(g)ΔH=+165.0kJ/mol
上述反应所得原料气中的CO能使合成氨催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如下图所示:
析图可知:
①相同温度时,CO平衡变换率与汽气比的关系是 。
②汽气比相同时,CO平衡变换率与温度的关系是 。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为Kp= 。随温 度的降低,该平衡常数 (填“增大”“减小”或“不变”)。
(2)Ⅱ.在熔融碳酸盐燃料电池中的应用以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
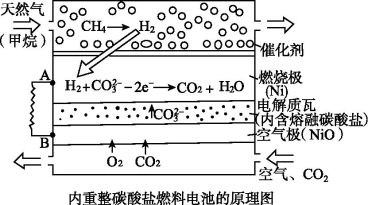
(1)外电路电子流动方向:由 流向 (填字母)。
(2)空气极发生反应的离子方程式是 。
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e-转移,有 g 精铜析出。
-
在工农业生产中锌,铜等金属有着广泛的应用。
(1)请写出锌元素的基态原子核外电子排布式______________。
(2)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-=CH3COO-),其反应是: [Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3]Ac•CO[醋酸羰基三氨合铜(I)]
[Cu(NH3)3]Ac•CO[醋酸羰基三氨合铜(I)]
①C、N、O三种元素的第一电离能由小到大的顺序为______________。
②羰基中碳原子的轨道杂化方式是______________,1mol乙酸分子中含有σ键的数目为______________
③与CO互为等电子体的一种阴离子是______________。
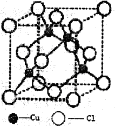
(3)如图是铜的一种氯化物晶体的晶胞结构,该晶胞中每个铜原子周围距离最近的氯原子数目为______________。
-
以天然气为原料合成氨是当下主流合成氨方式,其过程简示如下:
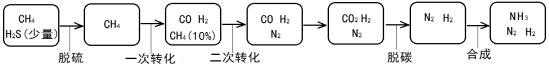
(1)甲烷脱硫的主要目的是 。
(2)甲烷一次转化发生反应:CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)  。
。
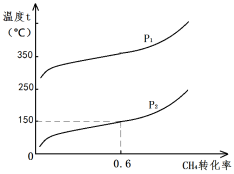
在20L的密闭容器中充入CH4(g)、H2O(g)各1mol,CH4的平衡转化率与温度、压强的关系如图。压强P1 (选填>、<、=)P2;若3min后在150℃、压强为P2时达到平衡,平均反应速率v(H2)= 。
(3)传统的化学脱碳法是用热碳酸钾溶液洗气,用什么方法可以使洗气后的碳酸钾溶液再生以循环使用? 。
铜洗能较彻底脱碳脱硫。醋酸亚铜溶于过量氨水形成的铜洗液,可吸收H2S、O2、CO、CO2等,该铜洗液吸收CO2的化学方程式: 。
(4)n(N2) :n(H2)=1 : 3原料气进入合成塔,控制反应条件之外采取什么措施提高原料气利用率? 。
(5)NaCl、NaBr、NaI混合溶液中滴入AgNO3溶液至c(Ag+)=0.07 mol·L-1,溶液中浓度比
c(Cl-):c(Br-):c(I-) = : :1。
| AgCl | AgBr | AgI |
| Ksp | 2×10-10 | 5×10-13 | 1×10-16 |
-
氢气作为清洁能源有着广泛的应用前景,采用天然气制备氢气的流程如下。

请回答下列问题:
Ⅰ.蒸汽转化:在催化剂的作用下,水蒸气将CH4氧化,结合图表信息回答问题。
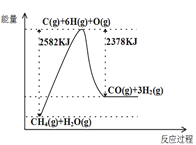
(1)该过程的热化学方程式是__________。
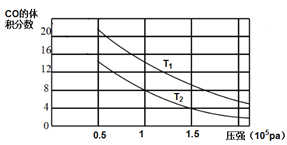
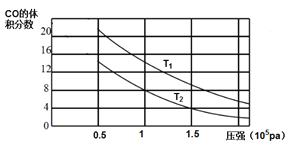
(2)平衡混合物中CO的体积分数与压强的关系如图所示,判断T1和T2的大小关系:T1_______T2(填“>”“<”或“=”),并说明理由__________。
(3)一定温度下,在1L恒容的密闭容器中充入1mol CH4和1mol水蒸气充分反应达平衡后,测得反应前后容器中气体的物质的量之比是3:4,计算该条件下反应的平衡常数为______________。
Ⅱ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅲ.模拟H2提纯工艺:将CO2和H2分离得到H2的过程如下:
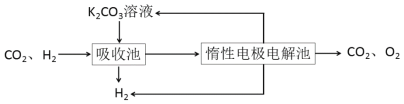
依据图示信息回答:
(4)吸收池中发生反应的离子方程式是_________。
(5)写出电解池中阳极发生的电极反应式________;结合化学用语说明K2CO3溶液再生的原因_________。
-
氢气作为清洁能源有着广泛的应用前景,采用天然气制备氢气的流程如下。

请回答下列问题:
Ⅰ.蒸汽转化:在催化剂的作用下,水蒸气将CH4氧化,结合图表信息回答问题。
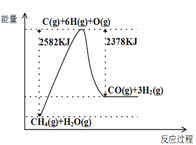
(1)该过程的热化学方程式是__________。
(2)平衡混合物中CO的体积分数与压强的关系如图所示,判断T1和T2的大小关系:T1_______T2(填“>”“<”或“=”),并说明理由__________。
(3)一定温度下,在1L恒容的密闭容器中充入1mol CH4和1mol水蒸气充分反应达平衡后,测得反应前后容器中气体的物质的量之比是3:4,计算该条件下反应的平衡常数为______________。
Ⅱ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅲ.模拟H2提纯工艺:将CO2和H2分离得到H2的过程如下:
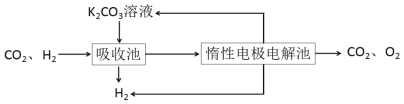
依据图示信息回答:
(4)吸收池中发生反应的离子方程式是_________。
(5)写出电解池中阳极发生的电极反应式________;结合化学用语说明K2CO3溶液再生的原因_________。
-
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g) 
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
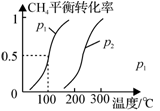
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) = 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
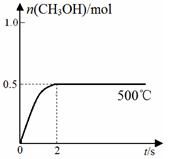
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
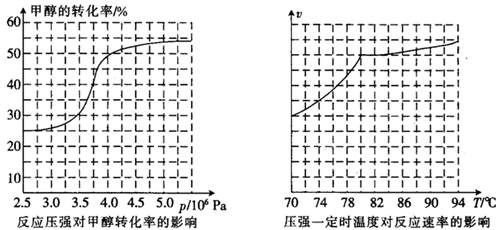
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。


=2,CH4、H2O、O2反应的化学方程式是______________________。
2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________




























