-
海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl 和MgSO4 及K、Br 等元素)的利用具有非常广阔的前景。
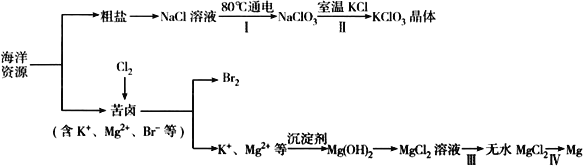
回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,要加入的试剂分别为__________________、__________________。
(2)写出步骤Ⅰ 中反应的总化学方程式为___________________________________。
(3)简述步骤Ⅱ中能析出KClO3 晶体而无其他晶体析出的原因是_____________________________。
(4)已知MgCl2 溶液受热时易水解生成Mg(OH)Cl,写出该过程的化学方程式__________________。
(5)为得到无水MgCl2,步骤Ⅲ的操作应为_____________________________。
(6)步骤Ⅳ中,电解熔融MgCl2 得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_________
A.H2 B.N2 C. CO2 D.空气
(7)海水中溴含量为65mg·L-1。若1L 海水中95%溴元素被氧化为Br2 经热空气吹出,溴单质残留量3%。最后用SO2 将90%Br2 还原成Br-,所得溶液体积为50mL。此过程的目的为________________。所得溶液中溴离子浓度为海水中溴离子浓度的_____________倍(精确到0.1)。
-
海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。
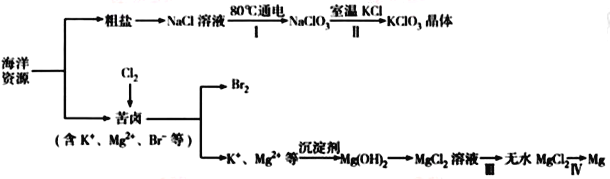
回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,要加入的试剂分别为__________________、__________________。
(2)写出步骤Ⅰ中反应的总化学方程式为___________________________________。
(3)简述步骤Ⅱ中能析出KClO3晶体而无其他晶体析出的原因是_____________________________。
(4)已知MgCl2溶液受热时易水解生成Mg(OH)Cl,写出该过程的化学方程式__________________。
(5)为得到无水MgCl2,步骤Ⅲ的操作应为_____________________________。
(6)步骤Ⅳ中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_____。
A.N2 B.H2 C. CO2 D.空气
(7)海水中溴含量为65mg·L-1。若1L海水中95%溴元素被氧化为Br2经热空气吹出,溴单质残留量3%。最后用SO2将90%Br2还原成Br-,所得溶液体积为50mL。此过程的目的为________________。所得溶液中溴离子浓度为海水中溴离子浓度的_____________倍(精确到0.1)。
【答案】 NaOH 溶液 Na2CO3溶液 Cl-+3H2O ClO3-+3H2↑ 此温度下 KClO3溶解度最小 MgCl2+H2O
ClO3-+3H2↑ 此温度下 KClO3溶解度最小 MgCl2+H2O Mg(OH)Cl+HCl↑ 通入氯化氢,蒸发浓缩冷却结晶 B 提高溴水的浓度 16.6倍
Mg(OH)Cl+HCl↑ 通入氯化氢,蒸发浓缩冷却结晶 B 提高溴水的浓度 16.6倍
【解析】试题分析:(1)除去Mg2+和Ca2+,可以用生成氢氧化镁、碳酸钙沉淀的方法;(2)根据电子守恒,步骤Ⅰ中电解氯化钠溶液,生成氯酸钠、氢气;(3)室温下 KClO3溶解度最小;(4)MgCl2溶液受热时易水解生成Mg(OH)Cl和HCl气体;(5)通入氯化氢可以抑制氯化镁水解;(6)根据金属镁的性质分析;(7)1L海水中95%溴元素转移到50mL溶液中,目的提高溴水的浓度;根据溴元素守恒计算溴离子浓度;
解析:(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,可以加入氢氧化钠溶液、碳酸钠溶液;(2)根据电子守恒,步骤Ⅰ中电解氯化钠溶液,生成氯酸钠、氢气;反应的总化学方程式为Cl-+3H2O ClO3-+3H2↑;(3)室温下 KClO3溶解度最小,所以向氯酸钠溶液中加入氯化钾能析出KClO3晶体而无其他晶体析出;(4)MgCl2溶液受热时易水解生成Mg(OH)Cl和HCl气体,反应的化学方程式是MgCl2+H2O
ClO3-+3H2↑;(3)室温下 KClO3溶解度最小,所以向氯酸钠溶液中加入氯化钾能析出KClO3晶体而无其他晶体析出;(4)MgCl2溶液受热时易水解生成Mg(OH)Cl和HCl气体,反应的化学方程式是MgCl2+H2O Mg(OH)Cl+HCl↑;(5)通入氯化氢可以抑制氯化镁水解,为得到无水MgCl2,步骤Ⅲ的操作应为通入氯化氢,蒸发浓缩冷却结晶;(6)A.Mg与N2 反应 生成Mg3N 2,故A错误; B.H2 与Mg不反应,故B正确; C. CO2 与Mg反应生成氧化镁和碳,故C错误; D.镁在空气中能燃烧,故D错误。(7)1L海水中95%溴元素转移到50mL溶液中,目的提高溴水的浓度;设所得溶液中溴离子浓度为x mg·L-1,根据溴元素守恒,
Mg(OH)Cl+HCl↑;(5)通入氯化氢可以抑制氯化镁水解,为得到无水MgCl2,步骤Ⅲ的操作应为通入氯化氢,蒸发浓缩冷却结晶;(6)A.Mg与N2 反应 生成Mg3N 2,故A错误; B.H2 与Mg不反应,故B正确; C. CO2 与Mg反应生成氧化镁和碳,故C错误; D.镁在空气中能燃烧,故D错误。(7)1L海水中95%溴元素转移到50mL溶液中,目的提高溴水的浓度;设所得溶液中溴离子浓度为x mg·L-1,根据溴元素守恒,  ,x=1078.2,所得溶液中溴离子浓度为海水中溴离子浓度的
,x=1078.2,所得溶液中溴离子浓度为海水中溴离子浓度的 16.6倍;
16.6倍;
【题型】综合题
【结束】
10
碳和氯元素及其化合物与人类的生产、生活密切相关。
I、氯的化合物合成、转化一直是科学研究的热点。
(1)一定条件下,氯气与氨气反应可以制备氯胺(NH2Cl)气体,己知部分化学键的键能:
| 化学键 | N—H | CI—Cl | N—Cl | H—Cl |
| 键能/ kJ•mol-1 | 391.3 | 243.0 | 191.0 | 431.8 |
则上述反应的热化学方程式为:__________________。
(2)氯胺(g)是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为______________________。
II.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
(1)在三个容积均为1L的密闭容器中以不同的氢碳比 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。
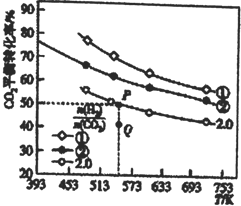
请回答下列问题:
①氢碳比①________②,Q点V(正) ___v(逆),该反应的ΔH ________0,(填“大于”或“小于”)
②若起始时,CO2、H2 的浓度分别为0.5mol·L-1、l mol·L-1,则P点对应温度的平衡常数的值为_____。P点对应的平衡常数__________Q点对应的平衡常数(填“>”、“<”或“=”)
(2)已知:碳酸H2CO3,K1=4.3×10-7、K2=5.6×10-11
草酸H2C2O4,K1=6.0×10-2、K2=6.0×10-5
①下列微粒可以大量共存的是___________(填字母)。
a.H2CO3、C2O42- b.CO32-、HC2O4- c. C2O42-、HCO3- d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外) 浓度由大到小的顺序是_________________________________。
-
海洋是个巨大的资源宝库,海水资源的利用具有非常广阔的发展前景。海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下所示:
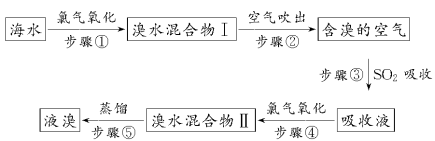
(1)步骤①反应的廊子方程式为_______________________________。
(2)步骤③反应的化学方程式为_________________________________。
(3)Br的原子序数是________,在周期表中位于第________周期、________族。
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:________________。
(5)为什么不直接用“溴水混合物Ⅰ”而要用“溴水混合物Ⅱ”进行蒸馏,得出液溴?
-
海水水资源的利用和海水化学资源的利用具有非常广阔的前景。下列有关叙述不正确的是
A.海带灼烧后的灰烬中碘元素以I2形式存在
B.从海水中制得的氯化钠可以用于生产漂白粉
C.以淡化后的浓海水为原料可以提高制溴的效益
D.淡化海水的方法有蒸馏法、电渗析法、离子交换法
-
海洋是资源的宝库,醢藏着丰富的化学元素,如氯、溴、碘等,海洋资源的综合利用具有非常广阔的前景。
(1)下列说法正确的是_________。
a.AgCl、AgBr、AgI的颜色依次变深 b.F、Cl、Br、I的非金属性依次增强
c.HF、HCl、HBr、HI的还原性的依次增强 d.F2、Cl2、Br2、I2与H2化合由难变易
(2)实验室从海藻灰中提取少量碘的流程如下图:

①氧化时,可以加入MnO2在酸性条件下进行氧化,反应的离子方程式为:_________。
②上述步骤①②③分离操作分别为过滤、_________、_________。
(3)从海水提取的粗盐中含有Mg2+、Fe2+、Ca2+和SO42—等杂质,“除杂”所需试剂有:①过量的NaOH溶液②过量的Na2CO3溶液③适量的盐酸④过量的BaCl2溶液.试剂的添加顺序为_________。
为使Ca2+完全沉淀,溶液中c(CO32—)应不小于_________mol/L。[已知Ksp(CaCO3)=2.9×10-9,离子浓度小于1×10-5mol/L视为完全沉淀]
(4)目前,利用食盐制取纯碱主要有“氨碱法”和“联合制碱法”两种工艺
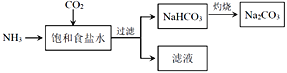
①能析出 NaHCO3的原因是_________。
②“氨碱法”是在滤液中加入_________产生NH3,循环使用,但产生大量的度弃物CaCl2;“联合制碱法“是在滤液中继续通入NH3,并加入NaCl粉末以制得更多的副产物_________。
③常温下,向饱和食盐水中通入NH3和CO2,当(HCO3—)=c(NH4+)时,溶液的pH_____7 (填“>”、“<”或“=”)。
-
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素。
(1)氯原子结构示意图是 ,碘在元素周期表中的位置是 ,HI的稳定性比HBr (填写“强”或“弱”)。
(2)向浓缩的海水中通入Cl2,可将Br-转化为Br2。再用“空气吹出法” 将Br2从浓海水中吹出,并用纯碱浓溶液吸收,生成NaBr、NaBrO3等。当有1 mol Br2被纯碱吸收时,转移的电子数为 。
下图是NaClO的发生装置。该装置主要利用了电解饱和食盐水的原理,可实现对海水的消毒和灭藻。

(3)写出装置中产生NaClO的化学方程式 。海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH) 2和CaCO3。 生成CaCO3的离子方程式是 。若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。试用电极反应式并结合必要的文字进行解释 。
NaOH溶液吸收SO2得Na2SO3,可用Na2SO3吸收SO2。在SO2被吸收的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(4)从上表可判断,NaHSO3溶液呈 (填“酸性”、“碱性”、“中性”),请用平衡原理解释: 。
(5)当吸收液呈中性时,溶液中离子浓度关系正确的是 (选填字母)。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
d.c(Na+)>c(SO32-)>c(HSO3-)>c(H+)=c(OH-)
-
海水资源的利用具有非常广阔的前景.
(1)海水淡化的主要方法有(只写出1种即可)______.
(2)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可以制备多种化工产品.
①用石墨电极电解饱和食盐水时,阳极的电极反应式是______.
②常温下,用石墨电极电解饱和食盐水,当阴极产生的气体体积为112mL(已折算为标准状况)时停止电解,此时溶液体积为1L,若忽略气体的溶解,最终溶液的pH约为______.
-
海水资源的利用具有非常广阔的前景.
(1)海水淡化的主要方法有(只写出1种即可)______.
(2)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可以制备多种化工产品.
①用石墨电极电解饱和食盐水时,阳极的电极反应式是______.
②常温下,用石墨电极电解饱和食盐水,当阴极产生的气体体积为112mL(已折算为标准状况)时停止电解,此时溶液体积为1L,若忽略气体的溶解,最终溶液的pH约为______.
-
海水资源的利用具有非常广阔的前景.
(1)海水淡化的主要方法有(只写出1种即可)______.
(2)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可以制备多种化工产品.
①用石墨电极电解饱和食盐水时,阳极的电极反应式是______.
②常温下,用石墨电极电解饱和食盐水,当阴极产生的气体体积为112mL(已折算为标准状况)时停止电解,此时溶液体积为1L,若忽略气体的溶解,最终溶液的pH约为______.
-
海水资源的利用具有非常广阔的前景.
(1)海水淡化的主要方法有(只写出1种即可)______.
(2)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可以制备多种化工产品.
①用石墨电极电解饱和食盐水时,阳极的电极反应式是______.
②常温下,用石墨电极电解饱和食盐水,当阴极产生的气体体积为112mL(已折算为标准状况)时停止电解,此时溶液体积为1L,若忽略气体的溶解,最终溶液的pH约为______.






