-
下列有关物质应用的说法正确的是
A. 生石灰用作食品抗氧化剂
B. 氢氟酸能与SiO2反应,故可用氢氟酸在玻璃上蚀刻标记
C. 铝罐可久盛咸的食物
D. 苏打是面包发酵粉的主要成分之一
难度: 简单查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液,再分别进行如下操作,结论正确的是
选项
操作
现象
结论
A
滴加BaCl2溶液
生成白色沉淀
原溶液中一定有SO42-
B
铁片置于冷的浓硫酸中
无明显现象
无化学反应发生
C
滴加氯水和CC4,振荡、静置
下层溶液显橙红色
原溶液中有Br-
D
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+、无K+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某工厂的废液中含有Al3+、Cu2+、Fe2+、Fe3+、Ag+。向该废液中滴加NaOH溶液至过量,放置一段时间后再滴加稀盐酸至溶液呈酸性,此时溶液中原有离子的物质的量没有发生变化的是
A. Fe2+ B. Fe3+ C. Ag+ D. A13+和Cu2+
难度: 中等查看答案及解析
-
下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
选项
待提纯的物质
选用的试剂
操作方法
A
NaHCO3(Na2CO3)
适量盐酸
蒸发结晶
B
CO2(CO)
O2
点燃
C
Mg(Al)
氢氧化钠溶液
过滤
D
CO2(HCl)
氢氧化钠溶液
洗气
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将某物质(可能为纯净物可能为混合物)置于盛有微量氧气和78 gNa2O2(足量)的密闭容器中,不断用电火花点燃或加热,直至反应结束,下列叙述错误的是
A. 原物质可以是CO或H2,也可以是两者的混合物,且比值为任意比
B. 若原物质是CH4与O2 的混合气体且体积比为2 :1,则反应结束后,装置内原有的氧气含量不变
C. 若原物质是CH4、HCHO 和HCOOH 的混合物,则各物质的物质的量的比值应当满足1:1: 1
D. 若原物质是84 g NaHCO3,则反应后的固体混合物与稀硫酸反应,消耗的硫酸一定是147 g
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 2mL0.5mo/L硅酸钠溶液中滴入适量盐酸制备硅酸胶体,所得胶粒数目为0.001NA
B. 1molNa2O2中含有的离子总数是4NA
C. 常温常压下,7.8gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA
D. 2.7gAl与足量氢氧化钠溶液反应,反应过程中转移的电子数目是0.15NA
难度: 中等查看答案及解析
-
某强酸性溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验(已知硝酸根离子在酸性环境中具有强氧化性,还原产物一般为气体)
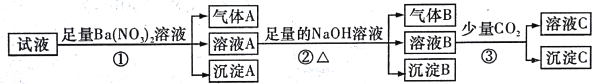
下列有关判断正确的是
A. 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B. 试液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中发生反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 沉淀B在空气中会迅速变为灰绿色,最后变为红褐色
难度: 困难查看答案及解析
-
有Mg、Al混合粉末5.1g完全溶于25mL4mol/L的盐酸中,若加入2mol/L的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠溶液的体积为
A. 25mL B. 50mL C. 75mL D. 100mL
难度: 中等查看答案及解析
-
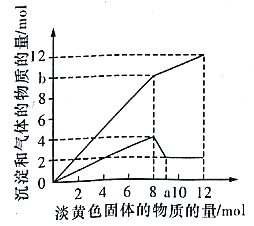
取等物质的量浓度的NaOH溶液两份A和B,每份100mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸体积之间的关系如图所示。下列说法正确的是

A. B 曲线中消耗盐酸0<V(HCl)<25mL时发生的离子反应为: OH-+H+=H2O,H++CO32-=HCO3-
B. 原NaOH溶液的物质的量浓度为0.75mol/L
C. B曲线最终产生的CO2体积(标准状况下)为112mL
D. 加盐酸之前A溶液中的溶质是碳酸钠和碳酸氢钠
难度: 困难查看答案及解析
-
常温常压下,用等质量的H2、CH4、O2、CO2分别吹出四个气球,其中气体为CH4的是
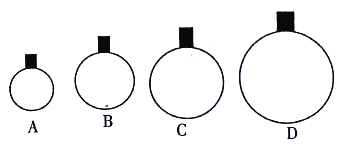
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知:将Cl2通人适量KOH溶液中,产物中可能有KCl、KClO、KClO3,且
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A. 若某温度下,反应后
=3,则溶液中
=5:2
B. 参加反应的氯气的物质的量等于0.5amol
C. 改变温度,反应中转移电子的物质的量ne-的范围:
D. 改变温度,产物中KCl的最大理论产量为
mol
难度: 困难查看答案及解析
-
将铜片放入0.1mol/LFeCl3 溶液中,反应一段时间后取出铜片,溶液中c(Fe3+) :c(Fe2+)=3:2,则反应后溶液中Cu2+与Fe3+的物质的量之比为
A. 1:3 B. 2:3 C. 3:1 D. 3:2
难度: 中等查看答案及解析