-
下列有关叙述不正确的是:( )
A.测定有机物结构方法较多,如红外光谱、紫外光谱、质谱、核磁共振氢谱、同位素示踪法等
B.“地沟油”危害健康,不仅是因为人体所必需的维生素E、脂肪酸油脂已经被破坏,营养低,而且含有黄曲霉素、苯并芘,这两种毒素都是致癌物质
C.化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础
D.利用可降解的生物质材料“玉米塑料”(主要成分为聚乳酸)替代一次性饭盒,可防止产生白色污染
难度: 简单查看答案及解析
-
下列说法正确的是:( )
A.纸层析法只能用于有色离子的分离,否则无法看到色斑
B.将20g硝酸钠和17g氯化钾放入100ml烧杯中,加35mL水,并加热、搅拌,使溶液浓缩至约为原来的一半时,趁热过滤即可得到硝酸钾晶体
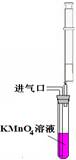
C.用如图所示装置测定空气中甲醛含量,若抽气速度过快会导致测定的甲醛含量偏低
D.用移液管取液后,将移液管垂直伸入容器里面,松开食指使溶液全部流出,数秒后取出
难度: 简单查看答案及解析
-
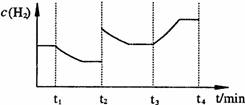
X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法正确的是:( )
A.四种元素的原子半径由小到大的顺序为:r(X)<r(Y)<r(Z)<r(W)
B.X、Y、Z既能形成离子化合物,又能形成共价化合物
C.X与其余三种元素之间形成的核外电子总数为10的微粒只有4种
D.H2Z的熔点比H2W高,是因为它们的晶体类型不同
难度: 简单查看答案及解析
-
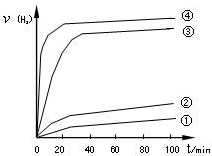
如图是一种可充电的锂离子电池充、放电的工作示意图。放电时该电池的电极反应式为:
负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的MnO2)
下列有关说法正确的是:( )
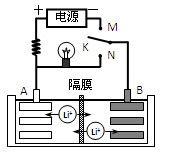
A.该电池的反应式为Li1-xMnO2+LixC6
LiMnO2+C6
B. 在整个充电或放电过程中都只存在一种形式的能量转化
C.K与N相接时,Li+由A极区迁移到B极区
D.K与M相接时,A是阳极,发生氧化反应
难度: 简单查看答案及解析
-
下列说法正确的是:( )
A.按系统命名法,有机物
可命名为3,7-二甲基-4-乙基辛烷
B.已知Ka是平衡常数,PKa=-lgKa
羧基(—COOH)
巯基(—SH)
H2O
pKa
3.7
9.8
16
则下图所示有机物1mol最多能消耗3molNaOH
C.
分子中所有原子共平面
D.碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种
难度: 简单查看答案及解析
-
下列说法正确的是:( )
A.反应A(g)
2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
B.已知25℃时,有关弱酸的电离平衡常数:HCN Ka=4.9×10-10 ; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11。则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3
C.已知:
共价键
C-C
C=C
C-H
H-H
键能/ kJ·mol-1
348
610
413
436
则反应
的焓变为ΔH = -384 kJ·mol-1
D、一定浓度的NaOH溶液,温度升高PH值不变
难度: 简单查看答案及解析
-
工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
已知:
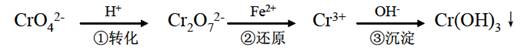
(1)步骤①中存在平衡:2Cr O42—(黄色)+2H+
Cr2O42—(橙色)+H2O
(2)步骤③生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)
Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3 的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1 时可视作该离子不存在下列有关说法中,正确的是:( )
A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42—离子浓度增大
B.步骤①中当2v(CrO42 一)=v(Cr2O72—)时,说明反应2CrO42—(黄色)+2H+
Cr2O72—(橙色)+H2O 达到平衡状态
C.步骤②中,若要还原1 mol Cr2O72一离子,需要12 mol(NH4)2Fe(SO4)2·6H2O。
D.步骤③中,当将溶液的pH 调节至6 时,则可认为废水中的铬已除尽
难度: 简单查看答案及解析