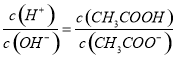-
下列说法正确的是:( )
A.反应A(g) 2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
B.已知25℃时,有关弱酸的电离平衡常数:HCN Ka=4.9×10-10 ; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11。则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3
C.已知:
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/ kJ·mol-1 | 348 | 610 | 413 | 436 |
则反应 的焓变为ΔH = -384 kJ·mol-1
的焓变为ΔH = -384 kJ·mol-1
D、一定浓度的NaOH溶液,温度升高PH值不变
-
下列说法正确的是 ( )。
A.反应A(g)2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb)kJ·mol-1
B.标准状况下,向0.1 mol·L-1的氨水中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-)
C.足量的锌铜合金与100 mL pH=1稀硫酸反应,反应3 s时测得pH=2,假设反应前后溶液的体积保持不变,则3 s内产生氢气的平均速率是33.6 mL·s-1
D.将浓度为0.1 mol·L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,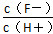 始终保持增大
始终保持增大
-
下列说法正确的是( )。
A.反应A(g)  2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1
2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1
B.标准状况下,向0.1 mol·L-1的氨水中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-)
C.足量的锌铜合金与100 mL pH=1稀硫酸反应,反应3 s时测得pH=2,假设反应前后溶液的体积保持不变,则3 s内产生氢气的平均速率是33.6 mL·s-1
D.将浓度为0.1 mol·L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变, 始终保持增大
始终保持增大
-
下列说法正确的是
A.反应A(g) ⇋ 2B(g) △H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=-( Ea- Eb)kJ/mol
B.常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同
C.某温度氯化钠在水中的溶解度是20 g,该温度饱和氯化钠溶液的质量分数为20%
D.将浓度为0.1 mol/L HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,始终保持增大
-
下列关于反应过程中能量变化的说法正确的是( )
A.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1
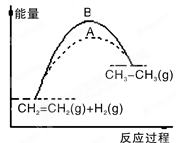
B.图中A、B曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH>0未使用和使用催化剂时,反应过程中的能量变化
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2
-
下列说法正确的是( )
A.反应A(g)⇌2B(g) △H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=(Eb-Ea)kJ/mol
B.反应CH4(g)+H2O(g)═CO(g)+3H2(g)在一定条件下能自发进行,该反应一定为放热反应
C.0.1 mol•L-1 CH3COOH溶液加水稀释,溶液中 增大
增大
D.电解精炼铜时,粗铜与外接电源正极相连,电解过程中电解质溶液中的c(Cu2+)保持不变
-
下列说法正确的是
A.反应A(g) 2B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea- Eb)kJ/mol
2B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea- Eb)kJ/mol
B.常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同
C.某温度氯化钠在水中的溶解度是20 g,该温度饱和氯化钠溶液的质量分数为20%
D.将浓度为0.1 mol/L HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变, 始终保持增大
始终保持增大
-
下列说法正确的是( )
A.反应A(g)⇌2B(g)△H,若正反应的活化能为EakJ·mol-l,逆反应的活化能为EbkJ·mol-l,则△H=-(Ea-Eb)kJ·mol-l
B.某温度下,氯化钠在水中的溶解度是20g,则该温度下的饱和氯化钠溶液溶质的质量分数为20%
C.将0.2mol·L-1的CH3COOH溶液与0.1mol·L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH)
D.将浓度为0.1mol·L-1HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变, 始终保持增大
始终保持增大
-
下列说法正确的是
A.反应A(g) 2B(g)△H,若正反应的活化能为EakJ.mol-l,逆反应的活化能为EbkJ.mol-l,则△H=-(Ea-Eb)kJ.mol-l
2B(g)△H,若正反应的活化能为EakJ.mol-l,逆反应的活化能为EbkJ.mol-l,则△H=-(Ea-Eb)kJ.mol-l
B.某温度下,氯化钠在水中的溶解度是20g,则该温度下的饱和氯化钠溶液溶质的质量分数为20%
C.将0.2mol.L-1的CH3COOH溶液与0.1mol.L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)一2c(OH-)=c(CH3COO-)-c(CH3COOH)
D.将浓度为0.1mol.L-1HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变, 始终保持增大
始终保持增大
-
下列说法正确的是
A. 某反应正、逆反应的活化能分别为EakJ/mol、EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
B. H2的热值为142.9kJ/g,则有2H2 (g)+O2(g)=2H2O (l) △H=-285.8kJ/mol
C. 将浓度为0.1mol/LHF溶液加水不断稀释过程中,  始终保持减小
始终保持减小
D. 混合前 ,等体积的混合后溶液中:
,等体积的混合后溶液中: 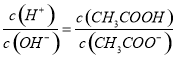
2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
的焓变为ΔH = -384 kJ·mol-1
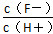 始终保持增大
始终保持增大