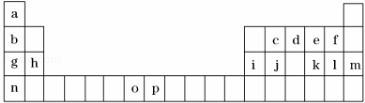
-
下列粒子属等电子体的是( )
A. NO和O2 B. CH4和NH4+ C. NH2—和H2O2 D. HCl和H2O
难度: 中等查看答案及解析
-
在下列的电子结构中,第一电离能最小的原子可能是( )
A. ns2np3 B. ns2np5 C. ns2np4 D. ns2np6
难度: 中等查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是( )
A. 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B. 在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
C. 向反应后的溶液加入乙醇,溶液没有发生变化
D. 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
难度: 中等查看答案及解析
-
下列各原子或离子的电子排布式错误的是 ( )
A. Na+: 1s22s22p6 B. F :1s22s22p5
C. O2—: 1s22s22p4 D. Ar: 1s22s22p63s23p6
难度: 简单查看答案及解析
-
以下电子排布式不是基态原子的电子排布式的是( )
A. 1s22s1 B. 1s22s12p1 C. 1s22s22p63s2 D. 1s22s22p63s1
难度: 简单查看答案及解析
-
下列关于乙烯(CH2=CH2)的说法不正确的( )
A. 乙烯分子中2个碳原子都是sp2杂化
B. 乙烯分子存在非极性键
C. 乙烯分子中4个H原子在同一平面上
D. 乙烯分子有6个σ键
难度: 中等查看答案及解析
-
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1mol N—N键吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是

A.N4属于一种新型的化合物
B.N4与N2互为同素异形体
C.N4沸点比P4(白磷)高
D.1molN4气体转变为N2将吸收882kJ热量
难度: 中等查看答案及解析
-
下列分子均属于极性分子且中心原子均为sp3杂化的是( )
A. CH4、P4 B. SO2、CHCl3 C. PCl3、SO3 D. NH3、H2O
难度: 中等查看答案及解析
-
bXn﹣和aYm+两离子的电子层结构相同,则a等于( )
A. b﹣m﹣n B. b+m+n C. b﹣m+n D. m﹣n+b
难度: 简单查看答案及解析
-
已知NA为阿伏伽德罗常数的值.下列说法不正确的是( )
A. 12g金刚石中平均含有2NA个σ键
B. 1molSiO2晶体中平均含有4NA个σ键
C. 12g石墨中平均含1.5NA个σ键
D. 1molCH4中含4NA个sp杂化的σ键
难度: 中等查看答案及解析
-
下列对一些实验事实的解释正确的是( )
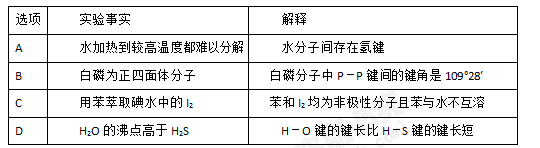
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列各组微粒的立体构型相同的是( )
A. CO2与SO2 B. CH4与CCl4 C. NH3与BF3 D. H3O+与SO3
难度: 中等查看答案及解析
-
已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H).下列推测肯定不正确的是( )
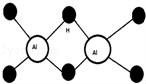
A. 该物质与水反应,属于氧化还原反应
B. Al2H6在空气中完全燃烧,产物为氧化铝和水
C. Al2H6分子中 氢为+1价,铝为﹣3价
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
难度: 中等查看答案及解析
-
膦(PH3)在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之。它的分子是三角锥形。以下关于PH3的叙述中,正确的是( )
A. PH3是非极性分子
B. PH3分子中有未成键的电子对
C. PH3中的P-H键的极性比NH3中N-H键的极性弱
D. PH3分子中的P-H键是非极性键
难度: 中等查看答案及解析