-
Sn(核电荷数为50)是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体.白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似.白锡的密度大于灰锡的密度.

(1)Sn元素外围电子排布式为______.
(2)SnCl2的一维链状聚合结构如图1所示,在分子结构中存在的化学键是______.
(3)SnCl4与CCl4中沸点较高的是______.原因是______.
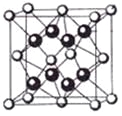
(4)锡的某种氧化物的晶胞如图2,其化学式为______.
(5)解释白锡分子的密度大于灰锡的密度的原因____________________.
-
[化学——选修3: 物质结构与性质](15分)Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。
(1)Sn元素价层电子排布式为 。
(2)SnCl2的一维链状聚合结构如图所示,在分子结构中标出所含有的配位键。其固体分子及气体分子中Sn的杂化方式为 。

(3)SnCl4分子的空间构型为 ,SnCl4与CCl4中
沸点较高的是 。
(4)锡的某种氧化物的晶胞如图,其化学式为 。

(5)解释白锡分子的密度大于灰锡的密度的原因: 。
(6)若灰锡的晶胞边长为a pm,计算灰锡的密度为 。
-
有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料。D与A位于同一主族,是构成地球上矿物质的主要元素。请回答下列问题:
(1)元素A能形成多种单质,其中的一种单质能用作电极、润滑剂与制造铅笔等。A与D所形成的化合物属于 晶体,其中心原子是以 杂化成键;
(2)B的核外电子排布式为 ,
(3)向含有C的硫酸盐中逐滴滴加氨水,所观察到的现象是 ;再向上述溶液中加入乙醇,有 ;原因是 ;
(4)A的氢化物比D的氢化物相比,熔点高是的 (填化学式),理由是
(5)下列说法正确的是( )
a.晶体析出规则是晶格能高的晶体最后析出
b.铜型和钾型都是密置层堆积方式
c.在干冰晶体中,每一个CO2周围有12个紧邻的CO2分子
d.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高
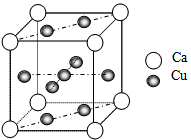
(6)下图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为_____________,已知两个最近的Ca原子之间的距离为apm,则该合金的密度为_____________g/cm3,(用含NA和a的代数式表示)。
-
铜及其化合物是人类最早使用的金属材料,铜及其化合物在现代的生产生活中仍然具有极其重要的作用。将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体。
(1)乙醇常温是液体而乙烷是气体的最主要原因:__________________;[Cu (NH3)4 ]SO4中,存在的化学键类型有 ______(填选项)。
A、离子键 B、金属键 C、配位键 D、非极性键 E、极性键
(2)乙醇可以在铜做催化剂的条件下被氧化为乙醛,请问乙醛分子中碳原子杂化类型为 ______。
(3)上述实验中涉及到的元素中,四种非金属元素的电负性由大到小的顺序为 ______。
(4)上述实验中最终析出的晶体的化学式是_________
A、[Cu (NH3)4]SO4•H2O B、[Cu (NH3)4]SO4•3H2O C、[Cu (NH3)4]SO4•5H2O
(5)[Cu (NH3)4 ]2+具有对称的空间构型,[Cu (NH3)4 ]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu (NH3)4 ]2+的空间构型为__________。
(6)1mol[Cu (NH3)4 ]2+中含有σ键数目为___________mol
(7)从结构的角度分析NH3 比NF3的键角大的原因:___________________
-
已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。请回答下列问题:
(1)Z的离子结构示意图是________;
(2)X、Y、W可组成一化合物,其原子个数之比为4:1:1。其化学式中含有的化学键有________。
(3)YX3分子的空间构型是________,Z的氢化物的稳定性比W的氢化物的稳定性_____ (填“强”或“弱”)。
(4)Z2W2分子中,W与Z均满足8e-稳定结构,则Z 2W2的电子式为。
-
已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。请回答下列问题:
(1)Z基态原子的核外电子排布式是________;
(2)X、Y可组成一化合物,其原子个数之比为5:1。其化学式中含有的化学键有________。
(3)YX3分子的空间构型是________,中心原子的杂化方式是________;Y的氢化物的沸点比W的氢化物的沸点________(填“高”或“低”)。
(4)Z2W2分子中,W与Z均满足8e-稳定结构,则Z 2W2的电子式为________。
-
下列有关说法不正确的是
A.配制SnCl2溶液时,首先用盐酸酸化蒸馏水,然后加入SnCl2晶体
B.加热CH3COONa溶液(预先滴有少量酚酞),溶液颜色变深
C.常温下,Fe(NO3)3溶液中由水电离产生的[H+]等于10–10 mol·L–1
D.NaHCO3作为发酵粉使用时,加入少量的明矾在水中能起到酸的作用
-
某元素的原子最外电子层排布是6s26p4,该元素或其化合物不可能具有的性质是( )
A.该元素单质可能是导体
B.该元素的最高化合价呈+6价
C.该元素能与氢气反应生成气态氢化物
D.该元素单质形成的晶体晶胞是简单立方
-
某元素的原子最外电子层排布是6s26p4,该元素或其化合物不可能具有的性质是
A.该元素单质可能是导体 B.该元素的最高化合价呈+6价
C.该元素能与氢气反应生成气态氢化物 D.该元素单质形成的晶体晶胞是简单立方
-
[化学-选修3:物质结构与性质]
铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)铁元素在周期表中的位置是________,铜的基态原子核外电子排布式为__________,元素铁与铜的第二电离能分别为:ICu="1958" kJ·mol-1、IFe="1561" kJ·mol-1,ICu比IFe大得多的原因是_______。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为______________。
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:
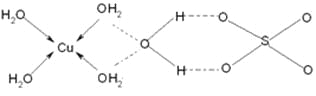
图中虚线表示_____________,SO42-的立体构型是__________,其中S原子的杂化轨道类型是___________;O原子的价电子排布图为__________________。
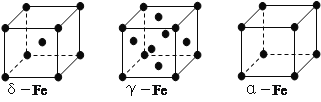
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为___________。
(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中原子之间的作用力是_______________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如右图)相似,该晶体储氢后的化学式为______________。