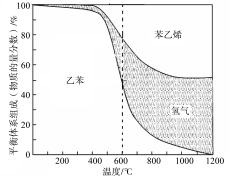
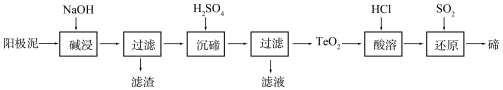
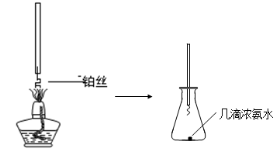
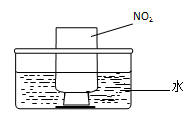
-
化学与生活密切相关,下列说法正确的是
A.蛋白质和油脂都是天然高分子化合物
B.CO2和CH4都是造成温室效应气体
C.蔗糖和麦芽糖水解产物均为葡萄糖
D.苯酚和甲苯遇FeCl3均显紫色
难度: 中等查看答案及解析
-
下列叙述Ⅰ和叙述Ⅱ均正确并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
SiO2是酸性氧化物
用盐酸刻蚀石英制品
B
氯化钠熔点很高
电解熔融氯化钠制备钠
C
铝具有还原性
铝粉和氧化铁粉末可发生铝热反应
D
硬铝是合金材料
硬铝在空气中生成致密氧化膜
难度: 中等查看答案及解析
-
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol Cl2与过量的镁铁反应,转移2nA个电子
B.常温下,16g CH4含有8nA个电子
C.1L 0.5 mol·L-1Na2SO4溶液中含有nA个SO42-
D.常温常压下,22.4LCO2含有nA个CO2分子
难度: 中等查看答案及解析
-
水溶液中能大量共存的一组离子是
A.H+、NO3-、I-、Cl-
B.Cu2+、Br-、H+、SO42-
C.Al3+、Mg2+、CO32-、NO3-
D.NH4+、Cl-、OH-、HCO3-
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、R的原子序数依次增大,X单质在暗处与H2剧烈化合并发生爆炸,Y位于第IA族,Z所处的周期序数与族序数相等,W元素最高正价与最低负价之和为0,R与X同族,则
A.原子半径:Z>Y>X
B.X与R的核电荷数相差18
C.气态氢化物稳定性:W>R
D.Y与Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
下列实验的现象与对应结论均正确的是
选项
操作
现象
结论
A
将新制氯水滴到淀粉KI试纸上
试纸变蓝色
氧化性:I2>Cl2
B
将过量的CO2通入CaCl2溶液中
产生白色沉淀
酸性:HCl>H2CO3
C
FeSO4溶液中滴入酸性高锰酸钾溶液
紫色褪色
Fe2+有还原性
D
SO2通入溴水中
溶液褪色
SO2有漂白性
难度: 中等查看答案及解析
-
室温下,将一元酸HA溶液和NaOH溶液等体积混合,实验数据如表:
实验编号
起始浓度c(HA)
起始浓度c(NaOH)
反应后溶液的pH
①
0.1 mol·L-1
0.1 mol·L-1
9
②
x
0.2mol·L-1
7
下列说法正确的是
A.实验①反应前HA溶液中c(H+)=c(OH-)+ c(A-)
B.实验①反应后溶液中c(A-)>c(Na +)
C.实验②反应前HA溶液浓度x>0.2 mol·L-1
D.实验②反应后溶液中c(A-)+ c(HA)= c(Na+)
难度: 中等查看答案及解析
-
已知反应①:
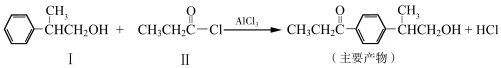
化合物Ⅱ可由化合物Ⅲ合成:
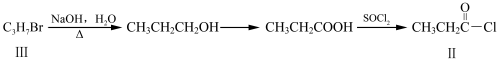
(1)化合物Ⅰ的分子式为 。反应①的反应类型为 。
(2)过量的化合物Ⅰ与HOOCCH2CH2COOH发生酯化反应,反应的化学方程式为 (注明条件)。
(3)化合物Ⅲ的结构简式为 。化合物Ⅲ可与NaOH乙醇溶液共热,反应的化学方程式 。
(4)化合物Ⅰ在一定条件下氧化生成化合物Ⅳ(分子式为C9H10O),化合物Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ的核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为2:2:1,Ⅴ的结构简式为 。
(5)一定条件下,1分子
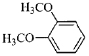 与1分子
与1分子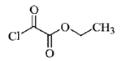 也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为 难度: 极难查看答案及解析