-
芳条结寒翠,请君添暖衣。深秋及寒冬的清晨,我们芜湖市经常出现大雾天气,雾中小液滴直径范围是( )
A.小于1nm B.在1~100nm间 C.大于100nm D.无法确定
难度: 简单查看答案及解析
-
今有一种固体化合物X,X本身不导电,但熔化状态或溶于水中能够电离,下列关于该化合物X的说法中,正确的是
A.X是一定为电解质 B.X可能为非电解质
C.X只能是盐类 D.X可以使任何化合物
难度: 中等查看答案及解析
-
下列分散系最不稳定的是
A.向氢氧化钠溶液中通入二氧化碳得到的无色溶液
B.向碘水溶液中滴加四氯化碳充分振荡后,静置后的下层液体
C.向沸水中滴加饱和的氯化铁溶液得到的红褐色液体
D.向硫酸铜溶液中加入氢氧化钠溶液得到的分散系
难度: 中等查看答案及解析
-
下列各组在溶液中的反应,反应物量不同,离子方程式不同且现象不同的是
A.Ba(OH)2和NaHSO4 B.Ba(OH)2和H2SO4
C.HCl 和 Na2CO3 D.Ca(HCO3)2 和NaOH
难度: 中等查看答案及解析
-
某人设想利用① 3FeCl2+4H2O
Fe3O4+6HCl+H2
②Fe3O4+3/2Cl2+6HCl
3FeCl3+3H2O +1/2O2
③3FeCl3
3FeCl2+3/2Cl2
这3个反应的联合与循环,主要用来生产能解决环境和能源问题的某种气体,该气体是
A.O2 B.Cl2 C.H2 D.HCl
难度: 中等查看答案及解析
-
下列实验装置图所示的实验操作,不能达到相应的实验目的的是
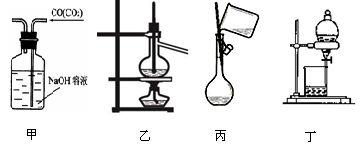
A.用甲除去一氧化碳气体中的二氧化碳气体
B.用乙分离费电相差较大的互溶液体混合物
C.丙向容量瓶中转移液体
D.用丁分离互不相溶的两种液体
难度: 中等查看答案及解析
-
有四位同学分别对四种溶液中所含的离子进行检测,结果如下,其中错误的是
A.Ca2+ HCO3- Cl- K+ B.OH- CO32- Cl- K+
C.Ba2+ Na+ OH- NO3- D.Cu2+ NO3- OH- Cl-
难度: 中等查看答案及解析
-
在标准状况下,ag气体X与bg气体Y的分子数相同,下列叙述正确的是
A.标准状况下,等质量的X和Y体积之比为b:a
B.同温同压下,气体X和气体Y的气体摩尔体积之比为b:a
C.25℃时,1g气体X和1g气体Y的分子数之比为a:b
D.同物质的量的气体X和Y的质量之比为b:a
难度: 中等查看答案及解析
-
把VL含有硫酸镁和硫酸铝的混合溶液分成两等份,一份加入含有amol氢氧化钠溶液,恰好使铝离子完全转化为偏铝酸根离子(1mol铝离子消耗4摩尔氢氧化钠生成1摩尔偏铝酸根离子);另一份加入含有bmol氯化钡溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中镁离子的浓度为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
某碳酸钠样品中含有碳酸钾,硝酸钠和硝酸钡三种杂质中的一种或两种。现将11g样品加入足量水中,样品全部溶解。再加入过量的氯化钙溶液,得到10g沉淀。对样品所含杂质的正确判断是
A.肯定有硝酸钠
B.肯定有硝酸钠,可能还含有碳酸钾
C.肯定没有硝酸钡,可能有硝酸钠
D.肯定没有碳酸钾和硝酸钡
难度: 中等查看答案及解析
-
Mg(ClO3)2在农业上可用做脱叶剂、催熟剂。可采用复分解反应制备:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示。下列有关叙述中不正确的是
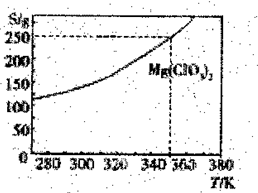
A.温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大
B.温度越高,Mg(ClO3)2饱和溶液的质量分数越大
C.350K,Mg(ClO3)2饱和溶液的物质的量浓度为
D.350K时,Mg(ClO3)2饱和溶液的质量分数为
难度: 中等查看答案及解析
-
化学工作者从有机反应:RH+Cl2(气)
RCl(液)+HCl受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。已知RCl难溶于水,产物HCl部分溶于RCl液体,试指出从上述反应产物混合物中分离得到盐酸的最佳方法是
A.蒸馏法 B.水洗分液法 C.过滤法 D.有机溶剂萃取法
难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数的值,下列叙述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.含有0.1NA个碳酸根离子的碳酸钠固体的质量为10.6g
C.标准状况下,aL的氧气和氮气的混合物含有的原子数为
D.标准状况下,11.2L四氯化碳含有的分子数位0.5NA
难度: 中等查看答案及解析
-
有一放置在空气中的氢氧化钾固体,经测定,其中含有氢氧化钾84.9%,碳酸氢钾5.1%,碳酸钾2.38%,水7.62%。将此样品若干克投入98克10%的盐酸中,待反应完全后,再需加入20克10%氢氧化钾溶液方能恰好中和。则蒸发中和后的溶液可得到固体质量为
A.20g B.40g C.48g D.36g
难度: 中等查看答案及解析
-
固体单质A和气体单质B在容积一定的密闭容器中恰好完全反应生成气体C,相同温度下测得容器内压强不变,若产物气体C的密度是原气体密度的4倍,则判断正确的是
A.生成物C中,A的质量分数为50%
B.反应前后的气体质量之比一定是1:4
C.单质A、B的摩尔质量之比是1:4
D.生成物C中A、B两元素的原子个数比为3:1
难度: 中等查看答案及解析
-
下列离子方程式改写成化学方程式正确的是
A.Zn2++2OH-=Zn(OH)2 ZnCO3+2NaOH=Zn(OH)2+Na2CO3
B.Ba2++SO42-=BaSO4 Ba(OH)2+H2SO4=BaSO4+2H2O
C.Ag++Cl-=AgCl AgNO3+KCl=AgCl+KNO3
D.Cu+2Ag+=Cu2++Ag Cu+2AgCl=CuCl2+2Ag
难度: 中等查看答案及解析
-
为了配制100mL1mol/L的氢氧化钠溶液,其中有下列几个操作:①氢氧化钠固体放在纸上进行称量②选刚用蒸馏水洗净的100mL容量瓶进行配制③氢氧化钠在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中④用蒸馏水洗涤烧杯内壁和玻璃棒2次,洗涤液也均转入容量瓶中⑤使蒸馏水沿玻璃棒注入容量瓶,直到溶液的凹液面恰好与刻度线相切。其中错误的是
A.①②③ B.③④⑤ C.②③⑤ D.①③⑤
难度: 中等查看答案及解析
-
已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其化学方程式是:PbSO4+2NH4Ac=Pb(Ac)2+(NH4)2SO4。当醋酸铅溶液中通入硫化氢时,有黑色沉淀硫化铅和弱电解质HAc生成。表示这个反应的有关离子方程式正确的是
A.Pb(Ac)2+H2S=PbS↓+2HAc B.Pb2++H2S=PbS↓+2H+
C.Pb2++2Ac-+H2S=PbS↓+2HAc D.Pb2++2Ac-+2H++S2- =PbS+2HAc
难度: 中等查看答案及解析