-
下列热化学方程式中,△H能正确表示物质的燃烧热的是
A. CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol
B. C(s)+1/2O2(g)=CO(g);△H=-110.5kJ/mol
C. H2(g)+1/2O2(g)=H2O(g);△H=-241.8kJ/mol
D. 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l);△H=-11036kJ/mol
难度: 中等查看答案及解析
-
在容积不变的密闭容器中进行反应X(g)+Y(g)⇌2Z(g)+W(s),己知反应中X、Y 的起始浓度分别为0.1mol•L-1、0.2mol•L-1,在一定条件下,当反应达到化学平衡时,各物质的浓度可能是( )
A. X为0.05mol•L-1 B. Y为0.1mol•L-1
C. Z为0.2mol•L-1 D. W为0.1mol•L-1
难度: 简单查看答案及解析
-
下列有关化学反应方向及其判据的说法中错误的是( )
A. 1mol H2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]
B. 凡是放热反应都是自发的,因为吸热反应都是非自发的
C. CaCO3(s)⇌CaO(s)+CO2(g)△H>0 能否自发进行与温度有关
D. 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
难度: 中等查看答案及解析
-
如图,下列各情况,在其中Fe片腐蚀由慢到快的顺序是( )
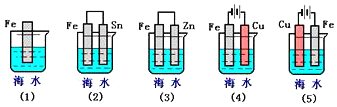
A. ⑤②①③④ B. ⑤①②④③ C. ④②①③⑤ D. ④③①②⑤
难度: 中等查看答案及解析
-
如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是( )
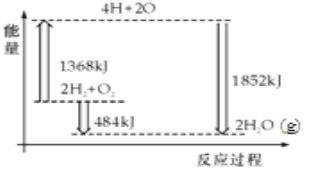
A. H2(g)和O2(g)反应生成H2O(g ),这是吸热反应
B. 2mol H2和1mol O2转化为4mol H、2mol O原子的过程中放出热量
C. 2mol H2(g)和1mol O2(g)反应生成2mol H2O(g),共放出484kJ能量
D. 4mol H、2mol O生成2mol H2O(g),共放出484kJ能量
难度: 中等查看答案及解析
-
实验室中的试纸种类很多、用途也比较广泛.下列试纸使用时不需要对试纸预先用蒸馏水润湿的是( )
A. 用蓝色石蕊试纸检验氯化氢气体
B. 用KI淀粉试纸检验氯气的存在
C. 收集氨气时,用红色石蕊试纸检验是否收集满
D. 用pH试纸检测稀盐酸溶液的pH
难度: 中等查看答案及解析
-
在25℃时,某稀溶液中由水电离产生的c(OH-)=10-10 mol•L-1.下列有关该溶液的叙述正确的是( )
A. 该溶液一定呈酸性
B. 该溶液中c(H+)可能等于10-5mol•L-1
C. 该溶液的pH可能为4也可能为10
D. 该溶液有可能呈中性
难度: 困难查看答案及解析
-
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
A.HCN易溶于水
B.1mol/L氢氰酸溶液的pH约为3
C.10mL1mol/LHCN恰好与10mL1mol/LNaOH溶液完全反应
D.HCN溶液的导电性比盐酸溶液的弱
难度: 中等查看答案及解析
-
用标准浓度的NaOH溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( )
①碱式滴定管用蒸馏水洗净后未用标准溶液润洗 ②锥形瓶中盛有少量蒸馏水,再加待测液 ③酸式滴定管用蒸馏水洗净后,未用盐酸润洗 ④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失 ⑤滴定后观察碱式滴定管读数时,俯视刻度线.
A. ①④ B. ①③ C. ②③ D. ④⑤
难度: 中等查看答案及解析
-
燃料电池是一种新型电池。某氢氧燃料电池的基本反应是:
X极:O2(g)+2H2O(l)+4e-=4OH-Y极:2H2(g)- 4e-+4OH-=4H2O(l)
下列判断正确的是
A. 该电池的电解质溶液为酸性 B. 电池总反应为2H2 + O2 =2H2O
C. X极是负极,发生氧化反应 D. 电池工作一段时间后溶液PH增大
难度: 中等查看答案及解析
-
可逆反应A(g)+ 4B(g)
C(g)+ D(g),在四种不同情况下的反应速率如下,其中表示反应进行得最快的是
A.vA=0.15mol/(L·min) B.vB=0.6 mol/(L·min)
C.vC=0.4 mol/(L·min) D.vD=0.005 mol/(L·s)
难度: 中等查看答案及解析
-
在某容积一定的密闭容器中,有下列可逆反应xA(g)+B(g)⇌2C(g),反应曲线(T表示温度,P表示压强,C% 表示C的体积分数)如图所示,试判断对图的说法中一定正确的是( )
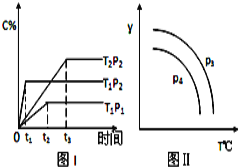
A. 该反应是吸热反应
B. x=2
C. P3<P4,y轴可表示混合气体的相对分子质量
D. P3>P4,y轴可表示C物质在平衡体积中的百分含量
难度: 困难查看答案及解析
-
.已知在一定条件下有CO(g)+H2O(g)
CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)
CO2(g)+H2(g) ΔH=a kJ/mol,反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
A.反应放出的热量为0.04a KJ
B.平衡时H2O的转化率为40%
C.若将容器的体积压缩为1 L,有利于该反应平衡正向移动
D.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
难度: 中等查看答案及解析
-
在恒温时,一固定容积的容器内通入1mol PCl5(g)发生如下反应:PCl5(g)⇌PCl3(g)+Cl2(g) 达到平衡时,再向容器内通入一定量的PCl5(g),重新达到平衡后,与第一次平衡时相比,PCl5的体积分数( )
A. 增大 B. 减小 C. 不变 D. 无法判断
难度: 困难查看答案及解析
-
为了探索外界条件对反应aX(g)+bY(g)⇌cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
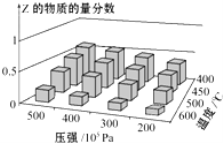
A. △H>0 a+b>c B. △H<0 a+b<c
C. △H<0 a+b>c D. △H>0 a+b<c
难度: 中等查看答案及解析
-
在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)⇌2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min
2
4
7
9
n(Y)∕mol
0.12
0.11
0.10
0.10
A. 反应前4min的平均反应速率υ(Z)=0.0125mol•L-1•min-1
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大
难度: 困难查看答案及解析
-
现有pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L,其pH与溶液体积的关系如图所示,下列说法正确的是( )
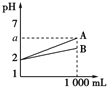
①A是强酸或比B强的弱酸,B是弱酸
②稀释后,A溶液的酸性比B溶液强
③若A、B均为弱酸,则2<a<5
④若A、B均为强酸,则A、B的物质的量浓度一定相等.
A. ①② B. ①③ C. ①③④ D. ②③④
难度: 简单查看答案及解析
-
向0.1mol•L-1的H2SO4溶液中滴入0.1mol•L-1过量的Ba(OH)2溶液,溶液的导电能力发生变化,其电流强度(I)随加入Ba(OH)2溶液的体积(V)的变化曲线正确的是
A B C D
难度: 中等查看答案及解析
-
下表是几种弱酸常温下的电离平衡常数:
CH3COOH
H2CO3
H2S
H3PO4
1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=9.1×10-8
K2=1.1×10-12
K1=7.5×10-3
K2=6.2×10-8
K3=2.2×10-13
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
难度: 困难查看答案及解析
-
25℃时,水的电离达到平衡:H2O⇌H++OH-△H>0,下列叙述正确的是( )
A. 向平衡体系中加入水,平衡正向移动,c (H+)增大
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量硫酸氢钠固体,
增大
D. 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
难度: 困难查看答案及解析