-
下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物
B.福尔马林、水玻璃、氨水均为混合物
C.烧碱、冰醋酸、四氯化碳均为电解质
D.稀豆浆、硅酸、氯化铁溶液均为胶体
难度: 简单查看答案及解析
-
如图表示1g O2与1g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能
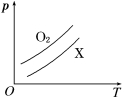
A.C2H4 B.CH4 C.CO2 D.NO
难度: 中等查看答案及解析
-
下列有关叙述正确的是( )
A.因为C和Si是同主族元素,故CO2和SiO2形成的晶体相同
B.在晶体中有阳离子就一定有阴离子
C.由于水分子间可以形成氢键故水分子的稳定性很强
D.在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键
难度: 简单查看答案及解析
-
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色.则下列说法中不正确的是( )

A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述正确的是
A.46g乙醇中存在的共价键总数为7NA
B.1mol -OH和1molOH-所含电子数均为9NA
C.密闭容器中1molNO与1molO2充分反应后的原子数为4NA
D.标准状况下,22.4L庚烷完全燃烧生成二氧化碳分子数为7NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.25℃时,50 g 98%浓硫酸和50 g 98%浓磷酸混合后含氧原子数为4NA
B.28 g聚乙烯中含有的碳原子数为2n NA (n为聚合度)
C.常温常压下,0.2 g D216O中含有的质子数、中子数和电子数均为0.1NA
D.6.8 g KHSO4晶体中含有0.1 NA个阳离子
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是
①12.4g白磷晶体中含有的P-P键数是0.6 NA
②电解精炼铜时转移了NA个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA
④2mol SO2和1 mol O2混合,在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA
⑤2.9g 2CaSO4·H2O含有的结晶水分子数为0.02 NA (2CaSO4·H2O相对分子质量为290)
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA
A.①②③④⑤⑦ B.②③⑤⑥ C.①③④⑤⑥ D.③④⑤⑥⑦
难度: 困难查看答案及解析
-
下列表述和方程式书写都正确的是( )
A.表示乙醇燃烧热的热化学方程式(△H的绝对值正确):
C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=﹣1367.0kJ•mol﹣1
B.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:
Al3++2SO42-+2Ba2++4OH-= AlO2-+2BaSO4↓+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D.用硫酸酸化的橙色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可以用于检测是否酒后驾驶:2Cr2O72﹣+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O
难度: 困难查看答案及解析
-
下列有关离子方程式书写或离子共存说法正确的是
A.在0.1 mol/L Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存
B.常温下,
=0.1mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3-
C.清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq)
SO42-(aq)+CaCO3(s)
D.向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-=BaSO4↓+Al(OH)3↓
难度: 困难查看答案及解析
-
由一种阳离子与两种酸根离子组成的盐称为混盐.混盐CaOC12在酸性条件下可以产生C12,下列关于混盐CaOC12的有关判断不正确的是( )
A.该混盐与硫酸反应产生1molC12时转移2NA个电子
B.该混盐的水溶液呈碱性
C.该混盐具有较强的氧化性
D.该混盐中氯元素的化合价为+1和﹣1
难度: 中等查看答案及解析
-
CsICl2常用于化学上的分子筛技术,它既有氧化性又有还原性,下列有关的说法正确的是( )
A.CsICl2有氧化性,是因为CS显+3价
B.CsICl2有还原性,是因为含有较强还原性的I﹣
C.酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色
D.在CsICl2溶液中滴加HNO3,可生成C12
难度: 中等查看答案及解析
-
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色.则下列分析中正确的是( )
A.白色沉淀是CuI2,棕色溶液含有I2
B.滴加KI溶液时,转移1 mol电子时生成1 mol白色沉淀
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>SO2>I2
难度: 困难查看答案及解析
-
将3.2g Cu跟30.0mL 10.0mol•L﹣1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3﹣的物质的量为( )
A. 0.5a mol B.(0.1+a)mol C.0.1a mol D.2a mol
难度: 困难查看答案及解析
-
亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害.其在酸性条件下会产生NO和NO2.下列有关说法错误的是( )
A.NaNO2既具有氧化性又具有还原性
B.食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害
C.NaNO2和胃酸作用的离子方程式为:2NO2﹣+2H+═NO↑+NO2↑+H2O
D.1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol
难度: 困难查看答案及解析
-
0.96g Mg跟含6.3g HNO3的稀溶液恰好反应完全,则HNO3的还原产物的摩尔质量可能是( )
A.30 g•mol﹣1或46 g•mol﹣1 B.44 g•mol﹣1或80 g•mol﹣1
C.28 g•mol﹣1 D.46 g•mol﹣1
难度: 中等查看答案及解析
-
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+,现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )

A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I﹣=2Fe2++I2
C.开始加入的K2Cr2O7为0.25 mol
D.K2Cr2O7与FeSO4反应的物质的量之比为1:3
难度: 困难查看答案及解析



