-
(14分)食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性: >Fe3+>I2;还原性:S2O32—>I-。3I2+6OH-=IO3—+5I-+3H2O;KI+I2
>Fe3+>I2;还原性:S2O32—>I-。3I2+6OH-=IO3—+5I-+3H2O;KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是________(填化学式);CCl4中显紫红色的物质是_________(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为____________、____________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式:________________。将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由__________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是__________________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+____________________。
-
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3﹣>Fe3+>I2;还原性:S2O32﹣>I﹣;3I2+6OH﹣═IO3﹣+5I﹣+3H2O;KI+I2 KI3
KI3
某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
(1)①第一份试液中滴加KSCN溶液显红色,该红色物质是 (用化学式表示);
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 。
(2)①KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式: 。
②将I2溶于KI溶液,在低温条件下,可制得KI3•H2O。该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由 。
(3)现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加KBrO3的物质的量的关系如图所示。请回答下列问题:

①已知b点时,KI反应完全,转移的电子数为 。
②b→c过程中,仅有一种元素的化合价发生了变化.则反应时氧化剂与还原剂的物质的量之比为 。
③d点时,n(KBrO3)为 。
-
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH===5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。下列说法中正确的是( )
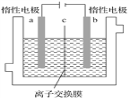
A. 电解过程中OH-从a极区通过离子交换膜c进入b极区
B. 随着电解进行,KOH溶液浓度会逐渐减小
C. a电极反应式:I--6e-+6OH-=== IO3-+3H2O,a极区的KI最终转变为KIO3
D. 当阳极有0.1 mol I-放电时,阴极生成6.72 L H2
-
氮氧化合物是目前造成大气污染的主要气体,而汽车尾气中就含有NO 等多种污染气体。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:
(1) 已知:N2(g)+2O2(g) 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol
则N2(g)+O2(g) 2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
(2) 若反应N2(g)+O2(g) 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
a.2υ正(N2)= υ逆(NO) b.混合气体密度不变
c.生成1molO2的同时生成2molNO d.混合气体平均相对分子质量不变
(3) 汽车尾气净化反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
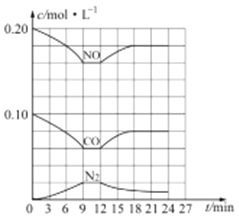
①该反应能自发进行的条件为_____ (填“高温”、“低温”或“任意温度”);
②在6~9 min 内,以CO 表示的平均反应速率 υ(CO)=________mol·L-l·min-1;
③第12min时改变的反应条件为_________ (填“升高温度”或“降低温度”);
④反应在第24min时的平衡常数K=____________(只列出计算式,无需计算结果),若保持温度不变,再向容器中充入CO、N2 各0.060mol,平衡将_________移动(填“正向”、“逆向”或“不”)。
-
氮氧化合物是目前造成大气污染的主要气体,而汽车尾气中就含有NO 等多种污染气体。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:
(1) 已知:N2(g)+2O2(g) 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol
则N2(g)+O2(g) 2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
(2) 若反应N2(g)+O2(g) 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
a.2υ正(N2)= υ逆(NO) b.混合气体密度不变
c.生成1molO2的同时生成2molNO d.混合气体平均相对分子质量不变
(3) 汽车尾气净化反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:

①该反应能自发进行的条件为_____ (填“高温”、“低温”或“任意温度”);
②在6~9 min 内,以CO 表示的平均反应速率 υ(CO)=________mol·L-l·min-1;
③第12min时改变的反应条件为_________ (填“升高温度”或“降低温度”);
④反应在第24min时的平衡常数K=____________(只列出计算式,无需计算结果),若保持温度不变,再向容器中充入CO、N2 各0.060mol,平衡将_________移动(填“正向”、“逆向”或“不”)。
-
下列物质久罝于空气中均会发生颜色变化,由于被氧气氧化而引起的是( )
A.溴化银 B.氯水 C.硫酸亚铁 D.浓硝酸
-
下列关于金属性质的叙述中正确的是( )
A.钠与氧气反应时,产物是由O2的用量决定的
B.铝箔在空气中受热可以熔化且会发生剧烈燃烧
C.金属与非金属发生反应时,被氧化的一定是金属
D.铁丝不论在空气中还是纯氧中都不会燃烧
-
下列做法对人体健康不会造成危害的是
A. 用工业盐(NaNO2)作咸味调味品
B. 用硫磺熏制银耳,使它颜色更白
C. 食盐中加入一定量的碘酸钾(KIO3)制取加碘食盐
D. 将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒
-
碘及其化合物在人类活动中占有重要地位。
(1)加碘食盐中含有碘酸钾(KIO3),工业上以电解法制备碘酸钾,电解设备如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:
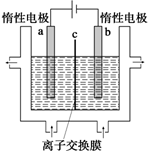
3I2+6KOH=5KI+KIO3+3H2O,再将该溶液加入________(阴极、阳极)区,另将氢氧化钾溶液加入另外一个区。使用________(阴、阳)离子交换膜,在阳极发生的电极反应式:________。
(2)碘化氢不稳定,分解反应的热化学方程式是2HI(g) I2(g)+H2(g) ΔH=+9.48 kJ·mol-1已知ΔS>0
I2(g)+H2(g) ΔH=+9.48 kJ·mol-1已知ΔS>0
①该反应属于( )
A.任何温度均自发 B.任何温度均不自发 C.高温自发 D.低温自发
②一定条件下,反应在一个带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
A.恒温,缩小体积,平衡常数不变
B.恒温,缩小体积,平衡不移动,颜色加深
C.恒容,升温,正向反应速率和逆向反应速率均增大
D.恒容,在容器中若投入2mol HI,达到平衡时吸收9.48 kJ 的热量
③一定温度下,平衡常数K=1/4,在2L的容器中,加入4molHI发生反应达到平衡,HI的转化率________。
-
汽车尾气里含有 NO 气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)⇌2NO(g) ΔH>0,已知该反应在 240℃时,平衡常数 K=64×10-4。请回答:
(1)该温度下,向 2 L 的密闭容器中充入 N2 和 O2 各 1 mol,5分钟后O2的物质的量为 0.5 mol,则 用N2表示的反应速率为________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________ (填字母序号)。
A.消耗 1 mol N2 同时生成 1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(3)将 N2、O2 的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________ (填字母序号)。
A.  B.
B. 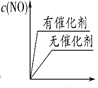 C.
C. 
(4)该温度下,某时刻测得容器内 N2 、O2、NO 的浓度分别为 2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和 3.0×10-3mol·L-1,此时反应________ (填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是________
KI3





 C.
C. 