-
【化学—选修3:物质结构与性质】
已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大。A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子, 是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等。
(1)写出基态F原子的价电子排布式 __________
(2)A、B、C三种元素第一电离能由大到小顺序为__________________ (用元素符号表示)
(3)A、C两元素形成的化合物AC2的分子空间构型__________________,AC2中心原子的杂化方式 __________,与 AC2互为等电子体的粒子的化学式_________ ,___________ (分子和离子各写一种)。
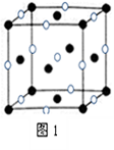
(4)D、E形成的一种离子化合物,在图1晶胞结构图中黑球表示E的位置,白球表示D的位置,已知该晶胞的边长为n cm,阿伏加德罗常数为NA,求晶胞的密度ρ= ____ g/cm3(用含a、NA的计算式表示)。
-
已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大。A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子, 是热和电最佳导体之一,;D与F不同周期,但最外能层电子数相等。
(1)写出基态D原子的价电子排布式 。
(2)A、B、C三种元素第一电离能最大的是 (用元素符号表示)其原因是 。
(3)A、C两元素形成的化合物AC2的分子空间构型 。与 AC2互为等电子体的粒子的化学式 , (分子和离子各写一种)。
(4)D、E形成的一种离子化合物,在图1晶胞结构图中黑球表示E的位置,白球表示D的位置,已知该晶胞的边长为a cm,阿伏加德罗常数为NA,求:晶胞的密度ρ= g/cm3(用含a、NA的计算式表示)。
(5)由F原子形成的晶胞结构如图2,F原子的半径为r,列式表示F原子在晶胞中的空间利用率 (不要求计算结果)。


-
X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素。
(1)N元素在周期表中的位置是______,M的基态原子的价层电子排布图为_____。
(2)Y、D、E三种元素的电负性从大到小的排列顺序为________,第一电离能从大到小的排列顺序为_______。(均用元素符号表示)。
(3)由X、D两种元素按原子个数比为2:1组成的化合物,其中心原子的杂化方式为__________,该化合物属于___________分子(填“极性”或“非极性”)。
(4)金属镍粉在化合物YE气流中轻微加热,生成无色挥发性液态Ni(YE)4,呈四面体构型。423K时,Ni(YE)4分解为Ni和YE,从而制得高纯度的Ni粉。试推测:该液态物质易溶于下列______中(填字母)。
A.水 B.硫酸镍溶液 C.苯 D.四氯化碳
(5)某盐中含NE42-离子,是一种水处理剂,加入稀硫酸后快速生成黄色溶液并释放出一种无色无味的气体,请写出该反应的离子方程式___________________。
-
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的价电子排布式为______________________。
(2)A的最高价氧化物分子中,其中心原子采取________杂化;BC3-的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为____________(填化学式)。
(5) CH3COOH中C原子杂化轨道类型为_________________。
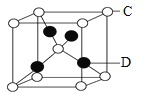
(6)元素D与元素C形成一种化合物其晶胞结构如图所示,该化合物的化学式为______.
-
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的电子排布式为_____。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC 的立体构型为________(用文字描述)。
的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________,电子式为__________。
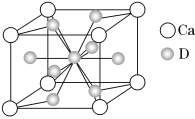
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比________。
(5)镍元素的原子价电子排布式为_____________________.
镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________________(填数值);氢在合金中的密度为_____________。(写出表达式即可)
-
A、B、C是短周期非金属元素,核电荷数依次增大。A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素。D、E是第四周期元素,其中E元素的核电荷数为29。D原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物易液化的原因是 ;
(3)已知A、C形成的化合物分子甲会造成温室效应,l mol甲中含有π键的数目为 ;
(4)基态D原子的外围电子排布式为 。DO2Cl2熔点:-96 .5℃,沸点: 117℃,则固态DO2Cl2属于 晶体。

(5)E的氢化物的晶胞结构如图所示,其化学式是 。
-
已知:A、B、C、D、E、F为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同。
请回答下列问题:
(1)D元素的原子中存在________种运动状态的电子;
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的为________(写出2种即可)
(3)与C同族且位于第四周期元素所形成简单气态氢化物的电子式为________;其与C的简单气态氢化物相比稳定性更________(填“强”或“弱”);
(4)F的基态原子核外电子排布式是_____________________________;其在元素周期表中的位置是:_______________________________;
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能________(填“大”或“小”)。
-
(12分)已知A、B、C、D、E、F均为周期表中前36号元素,且原子序数依次增大。A、B、C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等。A、F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道。D和E原子的第一至第四电离能如下表所示:
| 电离能/ kJ·mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |
⑴A、B、C三种元素的电负性最大的是▲ (填写元素符号),D、E两元素中D的第一电离能较大的原因是▲ 。
⑵F基态原子的核外电子排布式是▲ ;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于▲ 光谱(填“吸收”或“发射”)。
⑶根据等电子原理,写出AB+的电子式:▲ 。
⑷已知:F3+可形成配位数为6的配合物。组成为FCl3·6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3∶2∶1。则绿色配合物的化学式为▲ 。
A.[CrCl (H2O)5]Cl2·H2O B.[CrCl2(H2O)4]Cl·2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3] ·3H2O
-
已知A,B,C,D,E,F均为周期表中前36号元素,且原子序数依次增大.A,B,C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等.A,F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道.D和E原子的第一至第四电离能如下表所示:

(1)A,B,C三种元素的电负性最大的是__(填写元素符号),D,E两元素中D的第一电离能较大的原因是__.
(2)F基态原子的核外电子排布式是__;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于__光谱(填“吸收”或“发射”).
(3)根据等电子原理,写出AB+的电子式:__.
(4)已知:F3+可形成配位数为6的配合物.组成为FCl3•6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为__.
A.[CrCl(H2O)5]Cl2•H2O B.[CrCl2(H2O)4]Cl•2H2OC.[Cr(H2O)6]Cl3D.[CrCl3(H2O)3]•3H2O
-
已知:A、B、C、D、E为周期表中前四周期的五种元素,它们的原子序数依次增大。A的基态原子有3个不同的能级,各能级中电子数相等;B的基态原子2p能级上的未成对电子数与A原子的相同;B2- 离子与 C2+离子具有相同的稳定电子层结构;D有“生物金属”之称,D4+离子和氩原子的核外电子排布相同;E的基态原子的价电子排布式为3d84s2。
请回答下列问题:
(1)A、B、C三种元素的电负性由大到小的顺序是________________(填元素符号)。
(2)在D的单质晶体中,原子的堆积方式与Mg同,则其堆积方式是 ________,D原子的配位数是 。

(3)氢气是理想的清洁能源,E元素与镧(La)元素的合金可作储氢材料,该合金的晶胞如上图所示,晶胞中心有一个E原子,其他E原子都在晶胞面上,则该晶体的化学式为________。已知该晶体的密度为d g·cm-3,其晶胞的边长为a cm,则该物质的摩尔质量是________。(阿伏伽德罗常数用NA表示)







