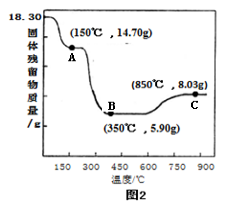
-
下列物质与其用途完全符合的是( )
①Na2O2﹣供氧剂 ②晶体Si﹣太阳能电池 ③干冰﹣人工降雨 ④NaCl﹣制纯碱
⑤Al2O3﹣焊接钢轨 ⑥NaClO﹣消毒剂 ⑦Fe2O3﹣红色油漆或涂料
⑧SO2﹣食品防腐剂 ⑨NH3﹣制冷剂 ⑩水玻璃﹣木材防火剂.
A.①②③④⑥⑦⑨⑩ B.①②③④⑤⑧⑨ C.①②③⑥⑦⑨⑩ D.①②③④⑥⑦⑨
难度: 简单查看答案及解析
-
科研、生产和生活中的下列做法利用了氧化还原反应的是( )
A.用乙醚从黄花蒿中提取青蒿素
B.由青蒿素(
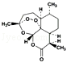 )合成双氢青蒿素(
)合成双氢青蒿素(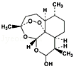 )的反应
)的反应C.空气净化器过滤净化空气
D.消毒柜通电产生臭氧的过程
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值.下列说法正确的是( )
①50mL12mol/L的盐酸与足量MnO2共热,转移电子数为0.3NA
②2.0gH218O与D216O的混合物中所含中子数为NA
③常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA
④常温常压下,6.72 L NO2与水充分反应转移的电子数目为0.2NA
⑤标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA
⑥10g46%的乙醇水溶液中所含氢原子数目为0.6NA
⑦60 g石英晶体中含有的Si﹣O键数目为2NA
⑧25℃时,100mlpH=13的Ba(OH)2溶液中OH﹣的数目为0.02NA
A.①②③⑥⑦⑧ B.②③ C.①②③④⑤ D.②③⑤
难度: 简单查看答案及解析
-
把少量过氧化钠投入下列溶液中,一定会有白色沉淀生成的是( )
A.1mol/L氢氧化钠 B.饱和碳酸氢钠
C.1mol/L硫酸亚铁 D.饱和碳
酸钠
难度: 中等查看答案及解析
-
根据右表提供的数据可知,在溶液中能大量共存的微粒组是( )
化学式
电离常数
CH3COOH
K=1.7×10﹣5
HCN
K=4.9×10﹣10
H2CO3
K1=4.3×10﹣7,K2=5.6×10﹣11
A.H2CO3、HCO3﹣、CH3COO﹣、CN﹣
B.HCO3﹣、CH3COOH、CN﹣、CO32﹣
C.HCN、HCO3﹣、CN﹣、CO32﹣ D.HCN、HCO3﹣、CH3COO﹣、CN﹣
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.加入铝粉能产生H2的溶液中可能大量共存的离子组:NH4+、Fe2+、SO42﹣、NO3﹣
B.常温下由水电离出的H+与OH﹣的浓度积为10﹣20mol2•L﹣2的溶液中可能大量共存的离子组:Na+、S2﹣、Cl﹣、CO32﹣
C.向FeI2溶液中通入过量Cl2的离子方程式:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
D.Ca(ClO)2溶液中通入少量CO2
的离子方程式:2ClO﹣+CO2+H2O═2HClO+CO32﹣
难度: 简单查看答案及解析
-
下列对实验现象的解释与结论均正确的是( )
选项
实验操作
实验现象
解释与结论
A
向某溶液中加入BaCl2溶液
有白色沉淀产生
生成了难溶于水的BaSO4,该溶液中一定含有SO42﹣
B
向少量AgNO3溶液中滴加适量NaCl溶液,再滴加少量稀NaI溶液
开始有白色沉淀生成,后有黄色沉淀生成
Ksp(AgI)<Ksp(AgCl)
C
向苯中滴入少量浓溴水,振荡,静置
溶液分层,上层呈橙红色,下层几乎无色
苯和溴水发生取代反应,使溴水褪色
D
向蔗糖中加入浓硫酸
变黑,放热,体积膨胀,放出刺激性气体
浓硫酸具有吸水性和强氧化性,反应中生成C、SO2和CO2等
难度: 困难查看答案及解析
-
化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
选项
现象或事实
解释
A
用浸有酸性高锰酸钾溶液的硅藻
土作水果保鲜剂
酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯
B
用氢氟酸蚀刻玻璃
SiO2是碱性氧化物,能溶于酸
C
过氧化钠作呼吸面具中的供氧剂
过氧化钠是强氧化剂,能氧化二氧化碳
D
Al(OH)3用作塑料的阻燃剂
Al(OH)3受热熔化放出大量的热
难度: 简单查看答案及解析
-
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
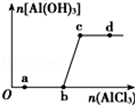
A.a点对应的溶液中
:Na+、Fe3+、SO42﹣、HCO3﹣
B.b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
C.c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
D.d点对应的溶液中:K+、NH4+、I﹣、HCO3﹣
难度: 中等查看答案及解析
-
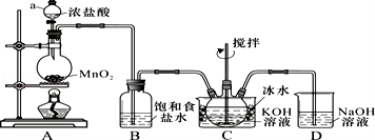
下列叙述正确的是( )
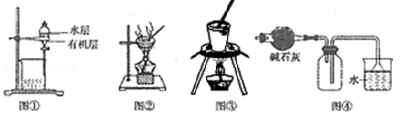
A. 图①中是用苯萃取碘水后的有机层和水层
B. 用图②所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 在从海带中提取碘的实验中,可用图③装置灼烧海带
D. 图④装置常用于收集干燥的NH3,若将碱石灰改成P2O5,可用于收集干燥的HCl
难度: 简单查看答案及解析
-
在一定条件下,X与强酸、强碱溶液反应如下.则下列说法正确的是( )
Y
X
Z.
A.若X为单质铝,则Y的气体产物只能是氢气
B.若X为NaHCO3,则Z一定有CO2
C.若Y、Z为含铝元素的两种盐,则X一定为Al(OH)3
D.若X为乙酸乙酯,则生成物Y、Z中均含有乙醇
难度: 中等查看答案及解析
-
如图为两种途径制备硫酸的过程(反应条件略),下列说法不正确的是( )
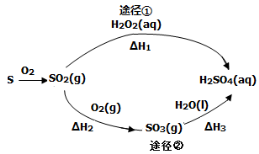
A.途径②增大O2浓度可提高SO2转化率
B.含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C.途径②中SO2和SO3均
属于
酸性氧化物
D.若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1) +O2 (g)为放热反应
难度: 简单查看答案及解析
-
能正确表示下列反应离子方程式的是( )
A.向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
B.双氧水中加入稀硫酸和KI溶液:2I﹣+H2O2+2H+=I2+O2↑+2H2O
C.Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42﹣+Ba2++3OH﹣=Fe(OH)3↓+BaSO4↓
D.草酸使酸性KMnO4溶液褪色,其离子方程式为:5H2C2O4+2MnO4﹣+6H+=2Mn2++10CO2↑+8H2O
难度: 简单查看答案及解析
-
下表中物质甲物质一定条件下与乙组中的4种物质都能发生反应的是( )
选项
甲物质
乙组中的物质
A
SO2
淀粉碘化钾溶液、氨水、KMnO4溶液、碳酸钠溶液
B
Mg
Cl2、CO2、NH4Cl溶液、NaOH溶液
C
SiO2
碳、NaOH溶液、氢氟酸、Na2CO3
D
稀硫酸
Al(OH)3、碳、Cu2(OH)
2CO3、Cu
难度: 中等查看答案及解析
-
2.8g Fe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,下列有关判断正确的是
A.反应后溶液中c(NO3-)=0.85mol/L
B.反应后的溶液最多还能溶解1.4gFe
C.反应后溶液中铁元素可能以Fe2+形式存在
D.1.12L气体可能是NO、NO2的混合气体
难度: 简单查看答案及解析
-
将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
操作
现象
①
加入NaOH溶液
有红褐色沉淀
②
加入Ba(NO3)2溶液
有白色沉淀
③
加入酸性KMnO4溶液
紫色褪去
④
加入K3[Fe(CN)6](铁氰化钾)溶液
有蓝色沉淀
A.②④ B.④ C.②③④ D.①②③④
难度: 简单查看答案及解析
-
下列有关叙述正确的是( )
A.“歼﹣20”飞机上大量使用的碳纤维是一种新型的有机高分子材料
B.铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝
C.酸碱指示剂变色、煤的液化、海水提溴、皂化反应都涉及化学变化
D.金属镁着火可使用干粉灭火器灭火,但不可用泡沫灭火器灭火
难度: 简单查看答案及解析
-
常温下,将一定量的氯气通入100mL 4mol/L的氢氧化钠溶液中,发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O.充分反应后,下列说法正确的是(NA为阿伏加德罗常数)( )
A.当通入的Cl2为2.24 L时,反应中电子转移数目为0.1 NA
B.当溶液中Na+为0.4 NA时,溶液中的Cl﹣为0.2 NA
C.当电子转移数目为0.2 NA时,溶液质量增加7.1 g
D.当溶液质量增加7.1 g时,溶液中ClO﹣约为0.1 NA
难度: 简单查看答案及解析