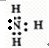-
以下各反应中,生成物的总能量高于反应物的总能量的是( )
A.甲烷燃烧 B.Ba(OH)2·8H2O与NH4Cl反应
C.铝片与盐酸反应 D.氧化钙与水反应
难度: 简单查看答案及解析
-
医学研究证明,用放射性53135I治疗肿瘤可收到一定疗效,下列有关53135I的叙述正确的是( )
A.53135I是碘的一种同素异形体 B.53135I是一种新发现的元素
C.53135I位于元素周期表中第四周期ⅦA族 D.53135I核内的中子数与核外电子数之差为29
难度: 简单查看答案及解析
-
根据物质结构和元素周期表进行分析判断,下列叙述不正确的是( )
A.第15列元素的最高价氧化物为R2O5
B.第三周期元素的离子半径,从左到右逐渐减小
C.同周期第ⅡA族与第IIIA族的元素原子序数之差可能为1或11或25
D.只含有非金属元素的化合物不一定是共价化合物
难度: 简单查看答案及解析
-
下列物质的化学用语正确的是( )
A.溴化钠的电子式:
B. 14C的原子结构示意图:
C.HClO的结构式:H-Cl-O D.原子核内有10个中子的氧原子:
难度: 简单查看答案及解析
-
下列物质中含有共价键的离子化合物是( )
①MgF2 ②Na2O2③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦N2
A.②③④⑤⑦ B.①②③④⑥ C.②③④ D.①③⑤⑥
难度: 简单查看答案及解析
-
若NA表示阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.7.8 g Na2O2所含离子总数为0.4 NA
B.2.0 gD2O(重水)含有的质子数是NA
C.标准状况下,0.5 NA个SO3分子所占的体积约为11.2 L
D.4℃时,18mL水分子中所含共价键的数目为4 NA
难度: 简单查看答案及解析
-
下列判断错误的是( )
A.酸性:
B.碱性:NaOH > Mg(OH)2 >Al(OH)3
C.沸点:I2>Br2>Cl2>F2 D.沸点:HI>HBr>HCl>HF
难度: 简单查看答案及解析
-
以下关于锂、钠、钾、铷、铯的叙述不正确的是( )
① 氢氧化物中碱性最强的是CsOH ② 单质熔点最高的是铯
③ 与O2反应均可得到多种氧化物 ④ 它们的密度依次增大,均要保存在煤油中
⑤ 其单质的还原性依次增强 ⑥ 它们对应离子的氧化性依次增强
A.①③⑤ B.②④⑥ C.②③④⑥ D.①⑤
难度: 简单查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
难度: 简单查看答案及解析
-
在一定条件下,RO与R-可发生反应:RO+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
A.元素R位于周期表中第ⅤA族
B.RO中的R只能被还原
C.R2在常温常压下一定是气体
D.若1 mol RO参与该反应,则转移的电子的物质的量为5 mol
难度: 简单查看答案及解析
-
元素周期表中第116号元素已由俄罗斯科学家找到。假设第116号元素的元素符号为R,则下列有关叙述中不正确的是( )
①R的非金属性比S强 ②R元素原子的内层电子共有110个 ③R是过渡金属元素 ④R元素原子的最高价氧化物对应的水化物为强酸 ⑤R元素的最高价氧化物的化学式为RO3
A.①③④ B.①②④ C.③④ D.②⑤
难度: 简单查看答案及解析
-
铊盐与氰化钾被列为A级危险品,铊(Tl)与铝同主族,Tl3+与Ag在酸性介质中发生反应:Tl3+ +2Ag===Tl+ +2Ag+且已知Ag+ +Fe2+===Ag+Fe3+,则下列推断正确的是( )
A.Tl+最外层有3个电子 B.氧化性:Tl3+>Ag+>Fe3+
C.Tl(OH)3与Al(OH)3相似,也是两性氢氧化物 D.铊位于第五周期ⅢA族
难度: 简单查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。常温下,S2Cl2遇水易发生反应,并产生能使品红褪色的气体。下列说法错误的是( )
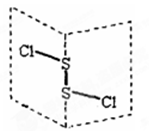
A.S2Cl2的电子式为
B.S2Cl2同时含有极性键和非极性键
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2 > S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:
2S2Cl2+2H2O = SO2↑+3S↓+4HCl
难度: 简单查看答案及解析
-
已知反应A2+B2===2AB,破坏1 mol A2中的化学键消耗的能量为Q1 kJ,破坏1 mol B2中的化学键消耗的能量为Q2 kJ,形成1 mol AB中的化学键释放的能量为Q3 kJ,则下列说法正确的是( )
A.若该反应为吸热反应,则Q1+Q2<2Q3
B.若该反应为放热反应,则Q1+Q2>Q3
C.若A2和B2的总能量之和小于生成的AB的总能量,则反应放热
D.若A2和B2的总能量之和大于生成的AB的总能量,则反应放热
难度: 简单查看答案及解析
-
铜锌原电池(如下图)工作时,下列叙述正确的是 ( )
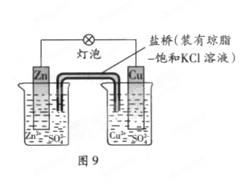
A.正极反应为:Zn—2e-=Zn2+
B.电池反应为:Zn+Cu2+=Zn2+ +Cu
C.在外电路中,电子从正极流向负极
D.盐桥中的K+移向ZnSO4溶液
难度: 简单查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热化学方程式为:
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ/mol,分别向1 L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸。恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是( )
A.ΔH1>ΔH2>ΔH3
B.ΔH2>ΔH3>ΔH1
C.ΔH1=ΔH2=ΔH3
D.ΔH1>ΔH3>ΔH2
难度: 简单查看答案及解析
-
原电池电极的“正”与“负”不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中正确的是( )
A.由Fe、Cu和FeCl3溶液组成的原电池中,负极反应式为:Cu-2e-===Cu2+
B.由Al、Cu和稀硫酸组成的原电池中,负极反应式为:Cu-2e-===Cu2+
C.由Al、Mg和NaOH溶液组成的原电池中,负极反应式为:Al+4OH--3e-===AlO+2H2O
D.由Al、Cu和浓HNO3溶液组成的原电池中,负极反应式为:Al-3e-===Al3+
难度: 简单查看答案及解析
-
已知:2CO(g)+O2(g)=2CO2(g) ΔH="-566" kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+
ΔH="-226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )

A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
难度: 简单查看答案及解析
-
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式CH4+10OH--8e-=CO32-+7H2O
③负极上是O2获得电子,电极反应式为 O2+2H2O+4e-=4OH-
④电池放电后,溶液pH不断升高
A.①② B.①③ C.①④ D.③④
难度: 简单查看答案及解析