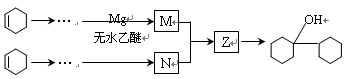
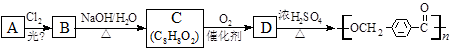-
联合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。有效“减碳”的手段之一是节能。下列制氢方法最节能的是
A.电解水制氢:2H2O
2H2↑+O2↑
B.高温使水分解制氢:2H2O
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O
2H2↑+O2↑
D.天然气制氢:CH4+H2O
CO+3H2
难度: 简单查看答案及解析
-
下列有关化学用语正确的是
A.碳原子的轨道表示式:
B.次氯酸分子的电子式:
C.CH4Si的结构式:
D.质量数为137的钡原子:
难度: 简单查看答案及解析
-
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
A.1mol洋蓟素最多可与11mol H2反应
B.不能与氯化铁溶液发生显色反应
C.一定条件下能发生酯化反应和消去反应
D.1mol洋蓟素最多可与5mol NaOH反应
难度: 简单查看答案及解析
-
如右图所示,将紧紧缠绕不同金属丝的铁钉放入培养皿中,再加入含有适量NaCl的溶液。下列叙述正确的是

A.a中铜丝上发生氧化反应
B.b中铁钉上发生还原反应
C.a、b中的铁钉均会发生锈蚀
D.a、b中反应时均有氢气放出
难度: 简单查看答案及解析
-
将等质量的①Na、②Na2O、③Na2O2、④NaOH、⑤Na2CO3·10H2O五种固体物质长时间露置于空气中,固体质量均会发生变化,最后的固体质量由小到大的顺序正确的是
A.⑤<④<③<②<① B.①<②<③<④<⑤
C.⑤<④<②=③<① D.⑤<③<④<②<①
难度: 简单查看答案及解析
-
化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:

有关上述曲线图的说法正确的是
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.曲线图②可以表示向一定量的盐酸中滴加一定浓度的氢氧化钠溶液时的pH的变化
C.曲线图③可以表示向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时的产生沉淀的物质的量变化
D.曲线图④可以表示所有的固体物质溶解度随温度的变化
难度: 简单查看答案及解析
-
常温下,在a、b、c三个盛有相同体积、相同浓度的稀H2SO4的烧杯中,分别加入等质量的表面积相同的锌。然后在a中同时加入适量CuSO4溶液,c中加入适量的无水CH3COONa固体。下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中可能正确的是
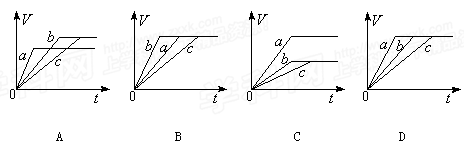
难度: 简单查看答案及解析
-
右图是一套实验室制备气体的装置,用于发生、干燥、收集和吸收有毒气体。下列各组物质能利用这套装置进行实验的是
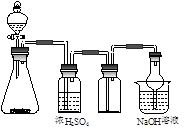
A.电石和水
B.MnO2和浓盐酸
C.Cu片和浓硝酸
D.Na2SO3和浓硫酸
难度: 简单查看答案及解析
-
已知硫铁矿在沸腾炉中煅烧时通入的气体原料是空气,且空气中N2的体积分数为0.8,O2的体积分数为0.2,则从沸腾炉排出的气体中SO2的体积分数可能是
A.0.10 B.0.12 C. 0.16 D.0.20
难度: 简单查看答案及解析



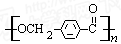 的路线:
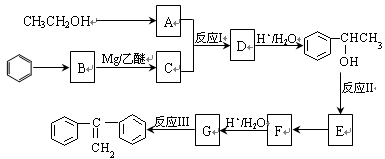
的路线: