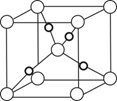
-
下列说法中不正确的是( )
① 淀粉、纤维素、蔗糖和麦芽糖都能水解,最终水解产物都为葡萄糖。
②将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色。
③ 用新制备的碱性Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖。
④“酸雨”是由大气中的碳、硫、氮的氧化物溶于雨水造成。
⑤ 明矾可以用于净水,主要是由于铝离子可以水解得到氢氧化铝。
⑥常温常压下,S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA(NA表示阿伏伽德罗常数的值)。
⑦铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线绞接在一起。
A.①②④⑦ B.④⑥⑦ C. ①②⑥⑦ D. ③④⑤
难度: 中等查看答案及解析
-
下列离子方程式表达正确的是( )
A.向氯化铁溶液中滴加HI溶液:2Fe3+ + 2HI = 2Fe2++2H++I2
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH—+Al3++2SO42-=2BaSO4↓+AlO
+2H2O
C.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+ = Al(OH)3↓+Al3++H2O
D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH--
难度: 困难查看答案及解析
-
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3 。则下列说法错误的是:( )
A.反应过程中,被氧化与被还原的元素的物质的量之比为1 :2
B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉
C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染
D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023
难度: 中等查看答案及解析
-
下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第6项X应为:( )
1
2
3
4
5
6
……
CH4
C2H6
C5H12
C8H18
……
X
……
A. C26H54 B.C20H42 C.C17H36 D.C53H108
难度: 中等查看答案及解析
-
下列物质转化在给定条件下能实现的是( )
①
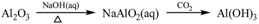
②
③
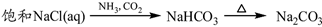
④
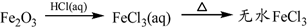
⑤
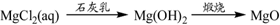
A②④⑤ B.②③④ C .①③⑤ D.①④⑤
难度: 中等查看答案及解析
-
某充电电池的原理如下图所示,溶液中c(H+)=2.0 mol·L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色(V 3+)变为紫色(V2+)。下列对此电池叙述正确的是( )
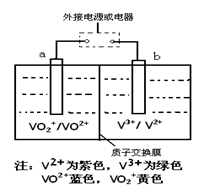
A.充电时,b极接直流电源正极,a极接直流电源负极
B.放电过程中,左槽溶液颜色由黄色变为蓝色
C.充电过程中,a极的反应式为:VO2++2H++e—= VO2+ +H2O
D.放电时,当转移1.0 mol电子时生成1.0 mol H+,且H+从左槽迁移进右槽
难度: 困难查看答案及解析
-
将铁粉和铜粉的均匀混合物,平均分成四等分,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
编 号
①
②
③
④
稀硝酸体积/mL
100 mL
200 mL
300 mL
400 mL
剩余金属/g
18.0 g
9.6 g
0
0
NO体积/L
2.24 L
4.48 L
6.72 L
V
经化学定量分析,下列推断正确的是( )
A.①中溶解了5.6g Fe B.硝酸的浓度为4mol/L
C.②中溶解了9.6g Cu D.④中V=6.72 L
难度: 中等查看答案及解析